题目内容
17.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 1.0 mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Cl-、SO42-、CO32- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、I-、S2-、SO42- |
分析 A.离子之间发生氧化还原反应;
B.$\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液,显碱性;
C.pH=0的溶液,显酸性;
D.离子之间发生氧化还原反应.
解答 解:A.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.$\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.pH=0的溶液,显酸性,不能大量存在CO32-,且Al3+、CO32-相互促进水解不能共存,故C错误;
D.I-、S2-均与ClO-发生氧化还原反应,不能共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解反应的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.配制480mL1.0mol•L-1NaNO2溶液,需称取溶质质量为( )
| A. | 13.8g | B. | 69g | C. | 34.5g | D. | 138g |
8.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)正确表示元素②在周期表中的位置第二周期第ⅣA族
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物对应的水化物是两性氢氧化物的元素是Al(填元素符号),写出它的氧化物与⑤的氢氧化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)⑧的单质有许多重要用途,写出其工业生产反应的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是(用离子符号表示)O2-、Na+、Mg2+.
| 列 周期 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物对应的水化物是两性氢氧化物的元素是Al(填元素符号),写出它的氧化物与⑤的氢氧化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)⑧的单质有许多重要用途,写出其工业生产反应的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)③⑤⑥三元素形成的简单离子具有相同的电子层结构,它们的离子半径由大到小顺序是(用离子符号表示)O2-、Na+、Mg2+.
5.下列说法中正确的是( )
| A. | 1mol H2的质量只有在标准状况下才约为2g | |
| B. | 标准状况下,22.4L氖气含有的原子数为2NA | |
| C. | 标准状况下,18g水的体积约为22.4L | |
| D. | 同温同压下,相同体积的气体单质含有的原子数目不一定相等 |
2.下列有关一定物质的量浓度溶液的配制说法正确的是( )
| A. | 将固体加入容量瓶中溶解并稀释至刻度线,配制成一定物质的量浓度的溶液 | |
| B. | 向盛有NaOH的烧杯中加蒸馏水使其溶解,并立即转入容量瓶中 | |
| C. | 用托盘天平称取10.60 g的Na2CO3固体,溶于1 L的水可配成0.1 mol/L的溶液 | |
| D. | 检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水 |
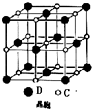 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题: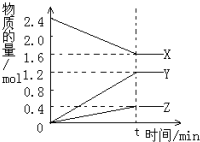 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t时到达平衡,依图所示: