题目内容
10.一定温度下,将 2mol SO2 和 1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,下列说法中正确的是( )| A. | 达到反应限度时,生成 SO3 为2 mol | |
| B. | 达到反应限度时,反应放出 197 kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率 |
分析 2SO2(g)+O2(g)?2SO3(g)为可逆反应,不能进行到底,达到反应限度时,正逆反应速率相等,各物质的浓度不变,以此解答该题.
解答 解:A.可逆反应中生成物不能完全转化为生成物,则生成SO3一定小于2 mol,故A错误;
B.热化学方程式中为完全转化时的能量变化,而将2mol SO2 和1mol O2充入一定容密闭容器中,不能完全转化,则放出的热量一定小于197kJ,故B错误;
C.平衡时浓度不变,由于平衡常数未知,不能确定物质的量关系,故C错误;
D.达到反应限度时,正逆反应速率相等,则达到反应限度时SO2的消耗速率必定等于SO3的消耗速率,故D正确.
故选D.
点评 本题考查化学平衡知识,为高频考点,把握热化学方程式的意义、化学平衡的可逆性为解答的关键,侧重分析与应用能力的考查,注意原子守恒及转化率决定物质的量关系,题目难度不大.

练习册系列答案
相关题目
1. 若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
 若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )
若用AG来表示溶液的酸度,其表达式为:AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].298K时,用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L 的MOH溶液,滴定曲线如图所示:下列说法正确的是( )| A. | 该滴定实验最好选择酚酞作为指示剂 | |
| B. | C点时加入盐酸溶液的体积等于10 mL | |
| C. | 滴定过程中从A点到D点,溶液中水的电离程度先逐渐减小,后逐渐增大 | |
| D. | 若B点加入的盐酸溶液体积为5mL,则所得溶液中:c(M+)+2c(H+)═c(MOH)+2c(OH-) |
15.下列叙述中,正确的是( )
| A. | 氨水显碱性 | B. | 铵盐不易溶于水 | ||
| C. | 氨气可以用浓硫酸进行干燥 | D. | NH3+HCl═NH4Cl属于氧化还原反应 |
2.下列有关概念或原理的叙述正确的是( )
| A. | 油脂是高分子化合物 | |
| B. | 氨基酸和蛋白质既能与酸反应,又能与碱反应 | |
| C. | 甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是他们既可以发生水解反应,又可以发生银镜反应 | |
| D. | 蛋白质溶液遇硫酸铜产生的沉淀能重新溶于水 |
19. 对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )
对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )
 对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )
对硫一氮化合物的研究是最为活跃的领域之一.如图是已经合成典型的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | B. | 该物质具有很高的熔、沸点 | ||
| C. | 该分子是非平面的八元环结构 | D. | 该物质与S2N2互为同素异形体 |
 .
.

 X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数比为2:1,其d轨道处于全充满状态.
X、Y、Z、W、U五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,U原子的K层电子数与最外层电子数比为2:1,其d轨道处于全充满状态.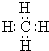 ,AxByCz的分子式AlC3H9.
,AxByCz的分子式AlC3H9.