题目内容
17.在水溶液中,能与Fe2+大量共存的是( )| A. | SO42- | B. | OH- | C. | CO32- | D. | ClO- |
分析 根据离子之间不能结合好生成沉淀、气体、水等,不能发生氧化还原反应,则离子大量共存,以此来解答.
解答 解:A.SO42-、Fe2+不反应,可大量共存,故A选;
B.OH-、Fe2+结合生成沉淀,不能共存,故B不选;
C.CO32-、Fe2+结合生成沉淀、不能共存,故C不选;
D.ClO-、Fe2+发生氧化还原反应,不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
5.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag+e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 电池放电时,外电路中,电子由负极向正极移动 |
8.现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如表所示:
请根据下列叙述回答问题:
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则X的化学式为CO2,该反应的化学方程式为2NaHSO4+Na2CO3=2Na2SO4+CO2↑+H2O.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别溶液中B的阴离子的方法是先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++CO2↑+H2O.
| 阳离子 | Na+、H+、Ba2+ |
| 阴离子 | OH-、CO32-、SO42- |
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则X的化学式为CO2,该反应的化学方程式为2NaHSO4+Na2CO3=2Na2SO4+CO2↑+H2O.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别溶液中B的阴离子的方法是先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++CO2↑+H2O.
12.化学与生产、生活息息相关.下列叙述错误的是( )
| A. | 古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| C. | 侯氏制碱法工业过程中应用了物质溶解度的差异 | |
| D. | “煤改气”、“煤改电”等工程有利于减少雾霾 |
2.下列有关化学用语表示正确的是( )
| A. | 质子数为78,中子数为117的铂原子:78117Pt | |
| B. | Al3+的结构示意图: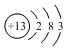 | |
| C. | 次氯酸钠的电子式: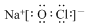 | |
| D. | 碳酸的电离方程式:H2CO3?2H++CO32- |
9.一种天然化合物X的结构简式如图所示.下列有关该化合物的说法中不正确的是( )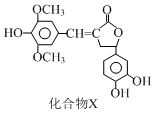

| A. | 每个X分子中含有1个手性碳原子 | |
| B. | 化合物X能使酸性高锰酸钾溶液褪色 | |
| C. | 1 mol化合物X最多能与5 mol NaOH发生反应 | |
| D. | 化合物X与溴水既能发生加成反应又能发生取代反应 |
6.室温下,在下列给定条件下的个溶液中,一定能大量共存的离子组是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-11的溶液:Na+、Ba2+、NO3-、CI- | |
| B. | 0.5mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、CI- | |
| C. | 1.0mol•L-1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42- | |
| D. | 使pH试纸显深蓝色的溶液:Na+、Mg2+、NO3-、HSO3- |
7.合成可降解聚合物G的某流程的最后一步如图,下列有关说法不正确的是( )

| A. | 已知该步转化过程中的原子利用率为100%,则X为CO2 | |
| B. | 有机物F属于芳香族化合物,但不属于芳香烃 | |
| C. | (C9H8O3)n既是高分子G的化学式也是其链节的化学式 | |
| D. | 已知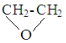 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 |
 ;
;