题目内容
12.化学与生产、生活息息相关.下列叙述错误的是( )| A. | 古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| C. | 侯氏制碱法工业过程中应用了物质溶解度的差异 | |
| D. | “煤改气”、“煤改电”等工程有利于减少雾霾 |
分析 A.明矾水解显酸性,可与铜锈反应;
B.Ba2+可使蛋白质发生变性;
C.侯氏制碱法工业利用碳酸氢钠的溶解度小的性质;
D.“煤改气”、“煤改电”等工程均可减少固体颗粒物排放.
解答 解:A.明矾水解显酸性,可与铜锈反应,则古代利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.Ba2+可使蛋白质发生变性,对人体有毒,但BaSO4在医学上可用作钡餐,BaSO4不溶于盐酸,故B错误;
C.侯氏制碱法工业利用碳酸氢钠的溶解度小的性质,则碳酸氢钠易从溶液中析出,故C正确;
D.“煤改气”、“煤改电”等工程均可减少固体颗粒物排放,有利于减少雾霾,故D正确;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途为解答的关键,侧重分析与应用能力的考查,注意化学与生活、环境的联系,题目难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
20.关于下列四个图象的说法中正确的是( )

| A. | 图①表示可逆反应“CO(g)+2H2(g)?CH3OH(g)”的△H<0 | |
| B. | 利用图②所示装置,可以实现在铁制品上镀铜 | |
| C. | 图③表示在实验室中用酸性KMnO4溶液滴定Na2SO3溶液 | |
| D. | 图④表示pH=a的NH3•H2O、NaOH稀释过程,其中线I表示NaOH |
20. 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表一:
表一:
根据表一中数据计算试样的pH=4.
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霆的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧能够降低燃煤时NO的排放,主要反应如下:
①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H1
若②N2(g)+O2(g)?2NO(g)△H2=+180.5kJ•mol-1
③CO(g)?C(s)+$\frac{1}{2}$O2△H3=+110.5kJ•mol-1
④C(s)+O2(s)?CO2(g)△H4=-393.5kJ•mol-1
则△H1=-746.5kJ•mol-1
(3)活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质).一定条件下发生反应:C(s)+2NO(g)?CO2(g)+N2(g)△H.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
①列式计算上述反应T1℃时的平衡常数K1=4;
②若T1<T2,则该反应的△H=<0(填“>”、“<”或“=”)理由是:从T1到T2,NO的浓度增大,说明升高温度,平衡逆向移动,由于升高温度平衡向吸热方向移动,所以该反应的逆反应为吸热反应,则△H<0.
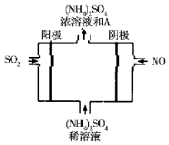
(4)利用如图所示的电解装置可将雾霆中的SO2、NO转化为(NH4)2SO4则物质A是硫酸(填名称),阴极的电极反应式是:NO+5e-+6H+=NH4++H2O.电解方程式为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4.
 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表一:
表一:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霆的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧能够降低燃煤时NO的排放,主要反应如下:
①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H1
若②N2(g)+O2(g)?2NO(g)△H2=+180.5kJ•mol-1
③CO(g)?C(s)+$\frac{1}{2}$O2△H3=+110.5kJ•mol-1
④C(s)+O2(s)?CO2(g)△H4=-393.5kJ•mol-1
则△H1=-746.5kJ•mol-1
(3)活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质).一定条件下发生反应:C(s)+2NO(g)?CO2(g)+N2(g)△H.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
②若T1<T2,则该反应的△H=<0(填“>”、“<”或“=”)理由是:从T1到T2,NO的浓度增大,说明升高温度,平衡逆向移动,由于升高温度平衡向吸热方向移动,所以该反应的逆反应为吸热反应,则△H<0.
(4)利用如图所示的电解装置可将雾霆中的SO2、NO转化为(NH4)2SO4则物质A是硫酸(填名称),阴极的电极反应式是:NO+5e-+6H+=NH4++H2O.电解方程式为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4.
7.地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题.用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一.
(1)Fe还原水体中NO3-的反应原理如图1所示.
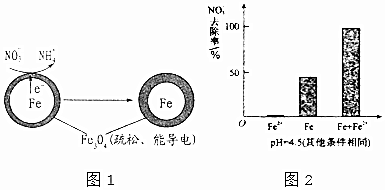
作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
在pH=4.5的水体中,NO3-的去除率低的原因是FeO(OH)不导电,阻碍电子转移.
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
(1)Fe还原水体中NO3-的反应原理如图1所示.

作负极的物质是铁;正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如表:
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 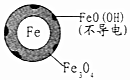 | 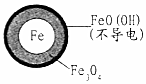 |
(3)为提高pH=4.5的水体中NO3-的去除率,某课题组在初始pH=4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图2:①此实验可得出的结论是本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率,Fe2+的作用可能是Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4.表中NO3-去除率和铁的最终物质形态不同的原因初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足.
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.(写出一条)
17.在水溶液中,能与Fe2+大量共存的是( )
| A. | SO42- | B. | OH- | C. | CO32- | D. | ClO- |
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素形成的一种单质是自然界中硬度最大的物质,Y位于周期表中VA族,Z是短周期中金属性最强的元素,W3-与氩原子核外电子排布相同.下列说法正确的是( )
| A. | 原子半径:r(Z)>r(W)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z3W中既含有离子键又含有共价键 | |
| D. | X的单质不能与Y的最高价氧化物对应的水化物反应 |
1.化学与生产、生活、社会密切相关.下列有关说法错误的是( )
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| C. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
2.实验室用粗铜制取NO2并冋收硝酸铜晶体[Cu(NO3)2•3H2O],下列装置能达到实验目的是( )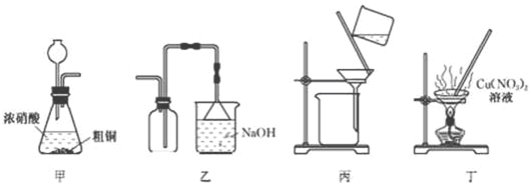

| A. | 用装置中制备NO2 | B. | 用装置乙收集NO2 | ||
| C. | 用装置丙过滤除去固体杂质 | D. | 装置丁蒸发至干得纯净硝酸铜晶体 |

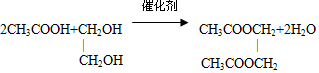 .
.