题目内容
9.一种天然化合物X的结构简式如图所示.下列有关该化合物的说法中不正确的是( )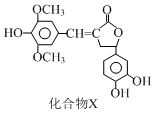
| A. | 每个X分子中含有1个手性碳原子 | |
| B. | 化合物X能使酸性高锰酸钾溶液褪色 | |
| C. | 1 mol化合物X最多能与5 mol NaOH发生反应 | |
| D. | 化合物X与溴水既能发生加成反应又能发生取代反应 |
分析 有机物含有酚羟基、碳碳双键、酯基,结合苯酚、烯烃和酯的性质解答该题.
解答 解:A.分子中与苯环、酯基相连的碳原子连接4个不同的原子团,为手性碳原子,故A正确;
B.含有碳碳双键和酚羟基,可被高锰酸钾氧化,故B正确;
C.能与氢氧化钠反应的官能团为酚羟基、酯基,1 mol化合物X最多能与4 mol NaOH发生反应,故C错误;
D.含有碳碳双键,可与溴水发生加成反应,含有酚羟基,可与溴水发生取代反应,故D正确.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,题目难度中等,注意体会官能团与性质的关系,明确酚、酯的性质即可解答,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
17.在下列生产生活过程中,涉及氧化还原反应的是( )
| A. | 从海带中提碘 | B. | 用明矾净水 | ||
| C. | 从海水中提取氯化镁 | D. | 用氦气填充飞艇 |
20.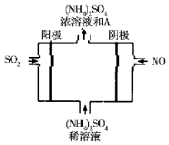 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表一:
表一:
根据表一中数据计算试样的pH=4.
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霆的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧能够降低燃煤时NO的排放,主要反应如下:
①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H1
若②N2(g)+O2(g)?2NO(g)△H2=+180.5kJ•mol-1
③CO(g)?C(s)+$\frac{1}{2}$O2△H3=+110.5kJ•mol-1
④C(s)+O2(s)?CO2(g)△H4=-393.5kJ•mol-1
则△H1=-746.5kJ•mol-1
(3)活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质).一定条件下发生反应:C(s)+2NO(g)?CO2(g)+N2(g)△H.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
①列式计算上述反应T1℃时的平衡常数K1=4;
②若T1<T2,则该反应的△H=<0(填“>”、“<”或“=”)理由是:从T1到T2,NO的浓度增大,说明升高温度,平衡逆向移动,由于升高温度平衡向吸热方向移动,所以该反应的逆反应为吸热反应,则△H<0.
(4)利用如图所示的电解装置可将雾霆中的SO2、NO转化为(NH4)2SO4则物质A是硫酸(填名称),阴极的电极反应式是:NO+5e-+6H+=NH4++H2O.电解方程式为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4.
 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表一:
表一:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霆的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧能够降低燃煤时NO的排放,主要反应如下:
①2NO(g)+2CO(g)?N2(g)+2CO2(g)△H1
若②N2(g)+O2(g)?2NO(g)△H2=+180.5kJ•mol-1
③CO(g)?C(s)+$\frac{1}{2}$O2△H3=+110.5kJ•mol-1
④C(s)+O2(s)?CO2(g)△H4=-393.5kJ•mol-1
则△H1=-746.5kJ•mol-1
(3)活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质).一定条件下发生反应:C(s)+2NO(g)?CO2(g)+N2(g)△H.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
②若T1<T2,则该反应的△H=<0(填“>”、“<”或“=”)理由是:从T1到T2,NO的浓度增大,说明升高温度,平衡逆向移动,由于升高温度平衡向吸热方向移动,所以该反应的逆反应为吸热反应,则△H<0.
(4)利用如图所示的电解装置可将雾霆中的SO2、NO转化为(NH4)2SO4则物质A是硫酸(填名称),阴极的电极反应式是:NO+5e-+6H+=NH4++H2O.电解方程式为:5SO2+2NO+8H2O=(NH4)2SO4+4H2SO4.
17.在水溶液中,能与Fe2+大量共存的是( )
| A. | SO42- | B. | OH- | C. | CO32- | D. | ClO- |
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X元素形成的一种单质是自然界中硬度最大的物质,Y位于周期表中VA族,Z是短周期中金属性最强的元素,W3-与氩原子核外电子排布相同.下列说法正确的是( )
| A. | 原子半径:r(Z)>r(W)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z3W中既含有离子键又含有共价键 | |
| D. | X的单质不能与Y的最高价氧化物对应的水化物反应 |
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| C. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| D. | 二氧化氯具有强氧化性,可用来漂白织物 |
1.化学与生产、生活、社会密切相关.下列有关说法错误的是( )
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| C. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
18.在给定条件下,下列选项所示的物质均能实现的是( )
| A. | Fe$→_{高温}^{H_{2}O}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$Ag(NH3)2OH(aq)$→_{水浴加热}^{麦芽糖}$Ag |
