题目内容
12.把含有氧化铁的铁丝投入足量的稀硫酸中,直到固体全部溶解.经分析,溶液中无Fe3+,且生成的Fe2+与反应产生的H2的物质的量之比为3:1.则原混合物中氧化铁与铁的物质的量之比为( )| A. | 1:2 | B. | 2:5 | C. | 3:2 | D. | 4:1 |
分析 反应的反应有,Fe2O3+6H+=2Fe3++3H2O、Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+,根据产生Fe2+与H2的物质的量之比为3:1及反应的方程式列式计算.
解答 解:设原混合物中含有xmolFe,ymolFe2O3,
Fe2O3+6H+=2Fe3++3H2O
y 2y
2Fe3++Fe=3Fe2+
2y y 3y
Fe+2H+=Fe2++H2↑
(x-y) (x-y) (x-y)
则[3y+(x-y)]:(x-y)=3:1,
y:x=2:5,
即:原混合物中Fe2O3与Fe的物质的量之比为2:5,
故选B.
点评 本题考查化学方程式的相关计算,题目难度中等,明确发生反应的实质为解答关键,注意根据方程式结合物质的性质计算.

练习册系列答案
相关题目
2.1mol乙烯(C2H4)与氯化氢气体完全加成后再与氯气取代,整个过程最多需氯气( )
| A. | 7 mol | B. | 6 mol | C. | 5 mol | D. | 4 mol |
3.如图是元素周期表的一部分,且都是短周期元素,下列关系判断正确的是( )


| A. | 原子半径:Y>X>W | B. | 氢化物的沸点:W>X>Y | ||
| C. | 氢化物的稳定性:R>Y>X | D. | 简单阴离子的还原性:Y>R>Z |
17.下列元素的单质在工业上用电解法生产的是( )
| A. | 氮 | B. | 氯 | C. | 溴 | D. | 碘 |
4.下列各组物质不互为同分异构体的是( )
| A. | NH4CNO和CO(NH2)2 | B. | CH2OHCHO和CH3COOH | ||
| C. | CH3OOCCH3和CH3COOCH3 | D. | 甘氨酸和CH3 CH2NO2 |
2.下列表示物质结构的化学用语或模型正确的是( )
| A. | 原子核内有7个中子的碳原子:${\;}_6^{13}C$ | |
| B. | HF的电子式: | |
| C. | CH4分子的球棍模型: | |
| D. | Cl-离子的结构示意图: |
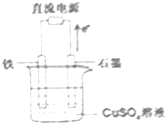 在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.
在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.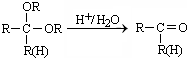
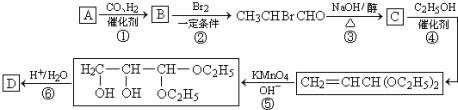
 CH2=CHCHO+NaBr+H2O.
CH2=CHCHO+NaBr+H2O.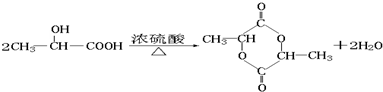 .
. 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体可制备H2和CO是一种新的能源利用方式,基本原理如图所示:
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体可制备H2和CO是一种新的能源利用方式,基本原理如图所示: