题目内容
20.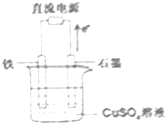 在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.
在如图所示装置中,石墨电极的电极反应式为4OH--4e-=2H2O+O2↑.如果开始加入的CuSO4足量,则电解一段时间,当电路中转移1.0mol电子时,要使溶液恢复至原浓度,可向其中加入的物质是CuO(填化学式),其质量为40g.
分析 电子由阳极流向电源的正极,根据图中的电子流向可知,石墨电极是阳极发生氧化反应,氢氧根离子发生氧化反应,电极反应式为4OH--4e-=2H2O+O2↑,电解足量的硫酸铜阳极是氢氧根离子放电,阴极是铜离子放电,所以要恢复原浓度,只要加入氧化铜,根据得失电子守恒计算加入氧化铜的量,由此分析解答.
解答 解:电子由阳极流向电源的正极,根据图中的电子流向可知,石墨电极是阳极发生氧化反应,氢氧根离子发生氧化反应,电极反应式为:4OH--4e-=2H2O+O2↑;电解足量的硫酸铜阳极是氢氧根离子放电,阴极是铜离子放电,所以要恢复原浓度,只要加入氧化铜,当电路中转移1.0mol电子时,所以有0.5mol的硫酸铜放电,需加入0.5mol的氧化铜,质量为:0.5×80=40g,
故答案为:4OH--4e-=2H2O+O2↑;CuO;40.
点评 本题考查了电解池原理及其应用,题目难度不大,明确电极判断和电极反应的书写方法是解题关键,注意熟练掌握电解池工作原理,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
10.下列有机物不能发生消去反应的是( )
| A. | 2-丙醇 | B. | 2,2-二甲基-1-丙醇 | ||
| C. | 2-甲基-2-丙醇 | D. | 氯乙烷 |
11.下列反应不属于氧化还原反应的是( )
| A. | CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 | B. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+HCl | ||
| C. | CuSO4+Zn=ZnSO4+Cu | D. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
8. 一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )
 一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )| A. | A处通氧气,B处通乙醇 | |
| B. | 电池工作时电子由a极沿导线经灯泡再到b极 | |
| C. | 电池正极的电极反应为:O2+2H2O+4e-=4OH- | |
| D. | 若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁 |

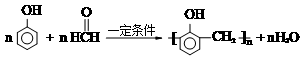 ,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.
,福尔马林是甲醛含量37%的水溶液,它的一个用途是浸制生物标本.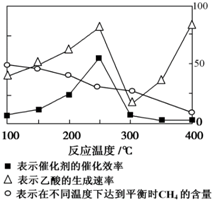 甲烷既是一种清洁能源,也是一种重要的化工原料.用催化剂可以将CO2和CH4直接转化成乙酸,反应方程式为:CO2(g)+CH4(g)?CH3COOH(g).
甲烷既是一种清洁能源,也是一种重要的化工原料.用催化剂可以将CO2和CH4直接转化成乙酸,反应方程式为:CO2(g)+CH4(g)?CH3COOH(g).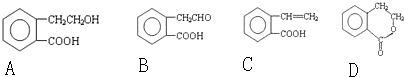
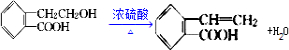 .
.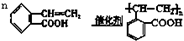 .
.