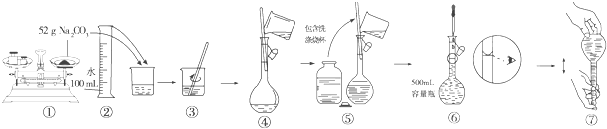
题目内容
常温时,以下4种溶液pH最小的是( )
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与0.01mol?L-1NaOH溶液等体积混合液 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:常温下,溶液中pH最小说明溶液中氢离子浓度最大,根据溶液中溶质结合氢离子浓度大小判断.
解答:
解:A.醋酸是弱电解质,所以0.01mol/L的醋酸溶液中氢离子浓度小于0.01mol/L;
B.0.02mol/L醋酸与0.01mol/LNaOH溶液等体积混合,二者完全反应后,醋酸剩余浓度为0.005mol/L,同时生成0.005mol/L的醋酸钠,则氢离子浓度大于A选项的;
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合,溶液中的溶质是0.01mol/L的醋酸和0.005mol/L的醋酸钠,氢离子浓度小于0.005mol/L;
D.pH=2的盐酸中氢离子浓度为0.01mol/L,pH=12的NaOH溶液中氢离子浓度为0.01mol/L,二者等体积混合,恰好反应生成强酸强碱盐,其溶液呈中性,则氢离子浓度等于10-7 mol/L;
所以氢离子浓度最大的是A,则pH最小的是A,
故选:A.
B.0.02mol/L醋酸与0.01mol/LNaOH溶液等体积混合,二者完全反应后,醋酸剩余浓度为0.005mol/L,同时生成0.005mol/L的醋酸钠,则氢离子浓度大于A选项的;
C.0.03mol/L醋酸与0.01mol/LNaOH溶液等体积混合,溶液中的溶质是0.01mol/L的醋酸和0.005mol/L的醋酸钠,氢离子浓度小于0.005mol/L;
D.pH=2的盐酸中氢离子浓度为0.01mol/L,pH=12的NaOH溶液中氢离子浓度为0.01mol/L,二者等体积混合,恰好反应生成强酸强碱盐,其溶液呈中性,则氢离子浓度等于10-7 mol/L;
所以氢离子浓度最大的是A,则pH最小的是A,
故选:A.
点评:本题考查了溶液酸碱性的判断,明确溶液中的溶质及溶质的性质即可解答,难度中等.

练习册系列答案
相关题目
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、若反应中转移的电子为nmol,则0.15<n<0.25 |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、与NaOH反应的氯气一定为0.3mol |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
下列各组无色溶液中,所含离子能大量共存的是( )
| A、K+ Na+ Cl- NO3- |
| B、Cu2+ H+ HCO3- Cl- |
| C、Na+ Ba2+ Cl- SO42- |
| D、Fe2+ H+ NO3- ClO- |
下列有关化学实验操作中“先”与“后”的说法正确的是( )
| A、高锰酸钾加热制备氧气,用排水法收集满氧气后,先撤离酒精灯,后移出导管 |
| B、给试管加热时,先固定局部加热,后给试管来回均匀加热 |
| C、在测定溶液的pH时,先用蒸馏水湿润,后用玻璃棒蘸取溶液点在试纸中部,再与比色卡比较 |
| D、点燃可燃性气体(如H2、CO、CH4)时,先检验气体纯度,后点燃 |
下列化学实验仪器名称的书写正确的是( )
| A、冷凝管 | B、溶量瓶 |
| C、长径漏斗 | D、蒸流烧瓶 |