题目内容
甲醇又称“木精”是重要的溶剂和基本有机原料,工业上常以CO和H2为原料合成甲醇.
(1)已知CO的燃烧热为-283.0kJ?mol-1,甲醇的燃烧热为-726.5kJ?mol-1,则CH3OH(1)不完全燃烧生成CO(g)和H2O(1)的热化学方程式为 .
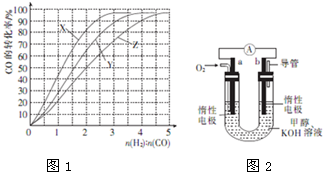
(2)工业上常利用反应:CO(g)+2H2(g)?CH3OH(g),△H<0合成甲醇,在230℃?270℃最为有利.为研究合成气最合适的起始组成比,在230℃、250℃和270℃进行实验,结果如图1所示,则230℃时的实验结果所对应的曲线是 (填字母,下同).该温度下工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是 (填字母).
A.1?1.5 B.2.5?3 C.3.5?4.5
(3)制甲醇所需要的氢气,可用下列反应制取:
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0某温度下,该反应的平衡常数K=1.
①若降低温度,该反应的K值将 (填“增大”,“减小”或“不变”)
②该温度下,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的物质的量浓度为0.5mol?L-1,则此时该反应的v(正) (填“>”“<”或“=”)v(逆)
(4)某研究小组设计了如图2所示的甲醇燃料电池装置.
①该电池工作时,OH-向 (填“a”或“b”)极移动.
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为 .

(1)已知CO的燃烧热为-283.0kJ?mol-1,甲醇的燃烧热为-726.5kJ?mol-1,则CH3OH(1)不完全燃烧生成CO(g)和H2O(1)的热化学方程式为
(2)工业上常利用反应:CO(g)+2H2(g)?CH3OH(g),△H<0合成甲醇,在230℃?270℃最为有利.为研究合成气最合适的起始组成比,在230℃、250℃和270℃进行实验,结果如图1所示,则230℃时的实验结果所对应的曲线是
A.1?1.5 B.2.5?3 C.3.5?4.5
(3)制甲醇所需要的氢气,可用下列反应制取:
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0某温度下,该反应的平衡常数K=1.
①若降低温度,该反应的K值将
②该温度下,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,反应进行一段时间后,测得H2的物质的量浓度为0.5mol?L-1,则此时该反应的v(正)
(4)某研究小组设计了如图2所示的甲醇燃料电池装置.
①该电池工作时,OH-向
②电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为
考点:热化学方程式,化学电源新型电池,化学平衡建立的过程,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据燃烧热书写热化学方程式根据盖斯定律来计算化学反应的反应热;
(2)依据反应是放热反应,温度越高,反应物转化率越小;CO为有毒气体反应时尽可能完全转化;
(3)①反应是放热反应,降低温度平衡正向进行;
②依据化学三段式列式计算,结合浓度商和平衡常数比较判断反应进行的方向;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
②电池反应为甲醇和氧气反应生成碳酸钾、水,结合电荷守恒书写离子方程式.
(2)依据反应是放热反应,温度越高,反应物转化率越小;CO为有毒气体反应时尽可能完全转化;
(3)①反应是放热反应,降低温度平衡正向进行;
②依据化学三段式列式计算,结合浓度商和平衡常数比较判断反应进行的方向;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
②电池反应为甲醇和氧气反应生成碳酸钾、水,结合电荷守恒书写离子方程式.
解答:
解:(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ?mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
即为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(2)工业上用反应CO(g)+2H2(g)?CH3OH(g),△H<0低压合成甲醇,在230℃~270℃最为有利,根据合成甲醇是放热反应,温度越低转化率越大,结合图象可知,270℃的实验结果所对应的曲线是Z;230℃的实验结果所对应的曲线是X,230℃时,工业生产釆用的合成气组成n(H2):n(CO)的比值为2.5?3时,CO转化率已经很高,故选B.
故答案为:X;B;
(3)①反应是放热反应,降低温度,平衡正向进行,该反应的K值将增大;
②若起始时c(CO)=1mol/L,c(H2O)=2mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.5 0.5 0.5 0.5
某时刻(mol/L) 1.5 0.5 0.5 0.5
Qc=
=
<K=1,反应正向进行,此时该反应v(正)>v(逆);
故答案为:>;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
故答案为:b;
②电池反应为甲醇和氧气反应生成碳酸钾、水,反应的离子方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O.
①CO(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 3 |
| 2 |
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ?mol-1-(-283.0kJ?mol-1)=-443.5kJ?mol-1,
即为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ?mol-1;
(2)工业上用反应CO(g)+2H2(g)?CH3OH(g),△H<0低压合成甲醇,在230℃~270℃最为有利,根据合成甲醇是放热反应,温度越低转化率越大,结合图象可知,270℃的实验结果所对应的曲线是Z;230℃的实验结果所对应的曲线是X,230℃时,工业生产釆用的合成气组成n(H2):n(CO)的比值为2.5?3时,CO转化率已经很高,故选B.
故答案为:X;B;
(3)①反应是放热反应,降低温度,平衡正向进行,该反应的K值将增大;
②若起始时c(CO)=1mol/L,c(H2O)=2mol/L,反应进行一段时间后,测得H2的浓度为0.5mol/L
H2O(g)+CO(g)?H2(g)+CO2(g)△H<0
起始量(mol/L) 2 1 0 0
变化量(mol/L) 0.5 0.5 0.5 0.5
某时刻(mol/L) 1.5 0.5 0.5 0.5
Qc=
| 0.5×0.5 |
| 1.5×0.5 |
| 1 |
| 3 |
故答案为:>;
(4)①装置图分析可知a为正极,b为负极,原电池中阴离子移向负极;
故答案为:b;
②电池反应为甲醇和氧气反应生成碳酸钾、水,反应的离子方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O.
点评:本题考查了热化学方程式和盖斯定律计算应用,化学平衡常数、化学平衡影响因素分析判断,原电池原理的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
常温时,以下4种溶液pH最小的是( )
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与0.01mol?L-1NaOH溶液等体积混合液 |
下列有关营养成分与人体健康关系叙述错误的是( )
| A、缺铁会患贫血症 |
| B、为防治佝偻病,过量补钙 |
| C、摄入糖分不足,会患低血糖 |
| D、缺碘人群可多食用海带、虾皮等含碘丰富的食物 |
联苯的结构简式: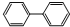 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )
 ,下列有关联苯的说法中正确的是( )
,下列有关联苯的说法中正确的是( )| A、分子中含有6个碳碳双键 |
| B、联苯的一硝基取代产物的3种 |
| C、它容易发生加成反应、取代反应,容易被强氧化剂氧化 |
D、它和蒽(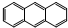 )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
下列反应中属于加成反应的是( )
| A、乙烷与氯气在光照条件下的反应 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、己烷与溴水混合振荡,静置后溴水层褪色 |
| D、在催化剂作用下,乙烯和水反应生成乙醇 |
某元素R的最高正价含氧酸的化学式为HnRO2n-2,则在其气态氢化物中,R的化合价为( )
| A、-(6-3n) |
| B、-(8-n) |
| C、-(12-3n) |
| D、-(14-5n) |