题目内容
11.下列有关实验操作、现象和解释或结论都正确的是( )| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
| B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
| C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 过量的Fe粉中加入HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓硝酸具有酸性,且具有强氧化性;
B.CO2通入BaCl2溶液中,不发生反应;
C.Al与稀硝酸反应生成硝酸铝、NO和水;
D.过量的Fe粉中加入HNO3,反应生成硝酸亚铁.
解答 解:A.浓硝酸具有酸性,且具有强氧化性,则蓝色石蕊试纸先变红色后褪色,故A正确;
B.因盐酸的酸性大于碳酸,则CO2通入BaCl2溶液中,不发生反应,无现象,故B错误;
C.Al与稀硝酸反应生成硝酸铝、NO和水,则观察到气体生成,且常温下Al遇浓硝酸发生钝化,故C错误;
D.过量的Fe粉中加入HNO3,反应生成硝酸亚铁,则滴入KSCN溶液无现象,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应和现象、离子的检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
1.在科学技术发展史上,为人类增产粮食、消除饥荒做出巨大贡献的化学成就是( )
| A. | 合成氨工业 | B. | 金属冶炼 | C. | 石油工业 | D. | 海水综合利用 |
2.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,正确的是( )
| A. | 钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2 | |
| B. | 铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中 | |
| C. | 化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色 | |
| D. | 密度为1.1 g•cm-3与密度为1.2 g•cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g•cm-3与1.2 g•cm-3之间; Na-K合金的熔点应介于Na和K熔点之间 |
19.现有下列十种物质:
①H2; ②Al2O3; ③CH4; ④CO2; ⑤H2SO4; ⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀硝酸;⑩FeCl3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(1)
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑦和⑩的溶液可以用丁达尔现象加以鉴别.
①H2; ②Al2O3; ③CH4; ④CO2; ⑤H2SO4; ⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀硝酸;⑩FeCl3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(1)
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
(3)⑦和⑩的溶液可以用丁达尔现象加以鉴别.
6.菜谱中记载:河虾不宜与西红柿同食.主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷.下列说法正确的是( )
| A. | 因为河虾中含有砷元素,所以不能食用 | |
| B. | “两者同食”发生的反应中维生素C作氧化剂 | |
| C. | 五价砷在维生素C作用下发生了还原反应 | |
| D. | 已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5 |
16.下列各组物质中,前者属于电解质,后者属于非电解质的是( )
| A. | 二氧化碳、BaSO4 | B. | 盐酸、蔗糖 | C. | KNO3、乙醇 | D. | NaOH、氯气 |
20.与钢相比,生铁的含碳量( )
| A. | 较多 | B. | 较少 | C. | 一样多 | D. | 不能确定 |
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu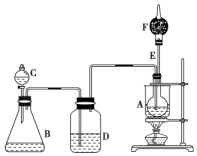 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.