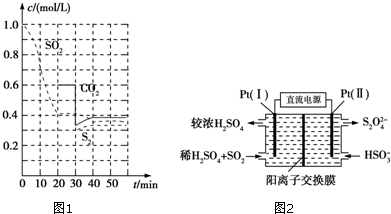
题目内容
12.已知乙醇的化学键类型如图所示,下列说法正确的是( )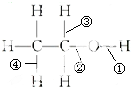
| A. | 乙醇与金属钠反应断裂②键 | B. | 乙醇与溴化氢反应断裂①键 | ||
| C. | 乙醇催化氧化变乙醛断裂①③键 | D. | 乙醇分子内脱水断裂①③键 |
分析 A、钠置换的是乙醇中-OH中的-H;
B、乙醇和溴化氢发生的是取代反应;
C、乙醇被催化氧化时,是将-OH中的-H和-OH所在C原子上的一个-H脱下来,和氧原子生成水;
D、乙醇分子内的脱水即为消去反应.
解答 解:A、钠置换的是乙醇中-OH中的-H,故断开的是①键,故A错误;
B、乙醇和溴化氢发生的是取代反应,是用-Br取代了乙醇中的-OH,故断开的是②键,故B错误;
C、乙醇被催化氧化时,是将-OH中的-H和-OH所在C原子上的一个-H脱下来,和氧原子生成水,故断开的是①③,故C正确;
D、乙醇分子内的脱水即为消去反应,消去的是-OH和-OH所在C原子的相邻C原子上的一个-H,故断开的是②④,故D错误.
故选C.
点评 本题考查了乙醇的化学性质中的反应原理,难度不大,掌握反应的机理多理解反应的进行帮助很大.

练习册系列答案
相关题目
2.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是②(填编号);
(2)元素⑨和⑩形成的化合物的化学式为Si3N4;元素⑦的原子价电子排布式是3s23p5;
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5°.三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是π键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是SO2(填分子式);
(4)根据对角线规则,Be与元素④的最高价氧化物的水化物的性质相似,它们都具有两性,显示这种性质的离子方程式是Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O;
(5)由以上某些元素形成的有机物苯酚(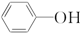 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子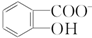 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
| 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中,第一电离能最小的是②(填编号);
(2)元素⑨和⑩形成的化合物的化学式为Si3N4;元素⑦的原子价电子排布式是3s23p5;
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5°.三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是π键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是SO2(填分子式);
(4)根据对角线规则,Be与元素④的最高价氧化物的水化物的性质相似,它们都具有两性,显示这种性质的离子方程式是Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O;
(5)由以上某些元素形成的有机物苯酚(
 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
3.基态原子的4s能级中只有1个电子的元素共有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 8 种 |
20.下列各组中的两个反应所属反应类型相同的是( )
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙炔在氧气中燃烧;乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 工业上由乙烯和水反应生成乙醇;由苯与液溴反应生成溴苯 | |
| D. | 由乙烯制取聚乙烯;由苯制取硝基苯 |
7.下列化学用语正确的是( )
| A. | 乙烯结构简式为C2H4 | B. | 乙醇的比例模型为 | ||
| C. | 间二甲苯的结构简式为 | D. | 甲烷的结构式为 |
2.已知反应A(g)+B(g)═C(g)+D(s) 的能量变化如图所示,下列说法正确的是( )

| A. | 该反应的能量变化表现为释放能量 | |
| B. | 该反应中反应物A、B的总能量小于生成物C的能量 | |
| C. | 该反应的能量变化是将化学能转化为热能、电能等其它形式 | |
| D. | 该反应能量变化的实质是旧化学键断裂与新化学键形成的结果 |
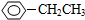 、HCOOH、CH3COOC2H5.
、HCOOH、CH3COOC2H5.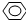 -OH ②CH2=CH2③CH≡CH ④
-OH ②CH2=CH2③CH≡CH ④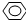 -CH2OH ⑤
-CH2OH ⑤ -CH3 ⑥CH3COO-
-CH3 ⑥CH3COO- ⑦CH3CH2CH2CH2Br
⑦CH3CH2CH2CH2Br