题目内容
14.为比较不同的催化剂对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.下列叙述中不正确的是( )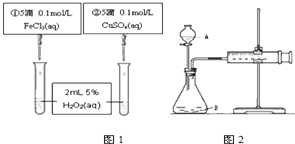
| A. | 图1实验可通过观察产生气泡快慢来比较反应速率的大小 | |
| B. | 若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| C. | 用图2装置可测定反应产生的气体体积 | |
| D. | 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
分析 A、据反应剧烈程度和反应现象的关系判断;
B、若图甲所示实验中反应速率①>②,则能够说明FeCl3比CuSO4对H2O2分解催化效果好;
C、据化学反应速率的概念分析;
D、据气密性检查原理判断.
解答 解:A、反应速率可以通过观察产生气泡的快慢来判断,故A正确;
B、若图甲所示实验中反应速率①>②,则能够说明FeCl3比CuSO4对H2O2分解催化效果好,但不一定是Fe3+和Cu2+,可能是硫酸根离子和氯离子,故B错误;
C、反应速率可以用单位时间内产生气体的快慢表示,故C正确;
D、关闭A处活塞,将注射器活塞拉出一定距离,若气密性不好,气体就能够加入,活塞不能回到原位,故D正确;
故选B.
点评 本题考查了化学反应速率的测定实验,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列有机反应的叙述中,错误的是( )
| A. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 | |
| B. | 苯乙烯在一定条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴水反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |
2.下列事实与氢键无关的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | NH3易液化 | |
| D. | 在相同条件下,H2O的沸点比H2S的沸点高 |
19.下列说法中正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 非金属元素之间不可能形成离子化合物 | |
| C. | 气体分子间一定存在分子间作用力,但分子内不一定含共价键 | |
| D. | 两种不同的非金属元素形成的化合物只存在极性共价键 |
6.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)①在元素周期表中的位置是(周期、族)第二周期第VIA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是: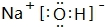 .
.
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)①在元素周期表中的位置是(周期、族)第二周期第VIA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是:
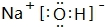 .
.(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
 .
.