题目内容
15. NH3可用来制尿素(
NH3可用来制尿素( )等化学肥料.
)等化学肥料.(1)工业上合成氨常用铁触媒作催化剂,请写出Fe3+基态核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5.
(2)CO2+2NH3$\frac{\underline{\;催化剂\;}}{△}$CO(NH2)2+H2O,则CO(NH2)2分子中C原子的杂化方式为sp2.其中C、N、O三种元素的电负性由小到大的顺序为C<N<O.
(3)与NH3互为等电子体的阳离子为H3O+.
(4)1mol CO(NH2)2中含有σ键的数目为7NA.
(5)铁和氨气反应的产物之一晶胞结构如图,写出该产物化学式Fe4N.
分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去3个电子变成Fe3+,根据构造原理书写Fe3+核外电子排布式;
(2)由尿素的结构式 可知,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3;C、N、O三种元素的非金属性依次增强,电负性依次增大;
可知,C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3;C、N、O三种元素的非金属性依次增强,电负性依次增大;
(3)NH3含有4个原子,价电子总数为8个电子,结合等电子体的定义分析;
(4)单键为σ的键,双键含有1个σ的键,CO(NH2)2分子中含有7个σ的键;
(5)利用均摊法确定氮化铁的化学式.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层3个电子变成Fe3+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d5 或[Ar]3d5 ,故答案为:1s22s22p63s23p63d5 或[Ar]3d5;
(2)由尿素分子的结构式 可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,C、N、O三种元素的非金属性依次增强,电负性依次增大,即C<N<O,
可知,尿素分子中C原子成2个C-N键、1个C=O键,没有孤对电子,杂化轨道数目为3,C原子采取sp2杂化,C、N、O三种元素的非金属性依次增强,电负性依次增大,即C<N<O,
故答案为:sp2;C<N<O;
(3)NH3含有4个原子,价电子总数为8个电子,则对应的等电子体有H3O+,
故答案为:H3O+;
(4)单键为σ的键,双键含有1个σ的键,CO(NH2)2分子中含有7个σ的键,1mol CO(NH2)2分子中含有σ的键的数目为为7NA,
故答案为:7NA;
(5)该晶胞中铁原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$,氮原子个数是1,所以氮化铁的化学式是Fe4N,
故答案为:Fe4N.
点评 本题考查较综合,涉及电子排布式的书写、杂化方式的判断、电负性的大小、等电子体的判断、晶胞的计算等,难度中等,侧重于考查学生的分析能力.

| A. | 向密闭容器中通入0.1molN2和0.3molH2,在一定条件下充分反应,容器中N原子数为0.2NA | |
| B. | Cu-Zn-CuSO4原电池工作时,当转移电子数为0.2NA时,正极溶解Zn6.5g | |
| C. | 电解102g熔融的Al2O3,能产生54g金属铝和33.6LO2,转移电子数为6NA | |
| D. | 电解精炼铜当转移电子数为2NA时,阳极溶解的铜和阴极析出的铜均为64g |
| A. | 无色透明的溶液:Na+、Al3+、Cl-、OH- | |
| B. | pH=1的溶液:Na+、NH4+、Cu2+、NO3- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、Cl-、Al3+ | |
| D. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| A. | 25% | B. | 35% | C. | 50% | D. | 75% |
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
| A. | 只有① | B. | 只有①②③ | C. | 只有①②③④ | D. | 都可以 |
| A. | Cl-的结构示意图  | B. | 铁红的化学式为Fe3O4 | ||
| C. | 甲醛的结构简式:CH2O | D. | CO2的电子式  |
 ;
;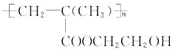 ,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料.请写出下列有关反应的化学方程式: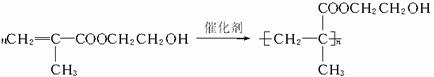 .
.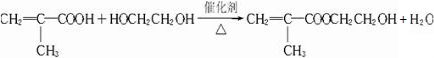 .
. .
.