题目内容
10.将足量的Na2O2与16.0g CO、H2、O2混合气体共同置于一密闭容器中,用电火花引燃,使其完全反应.反应后Na2O2增重12.0g,则原混合气体中O2的质量分数是( )| A. | 25% | B. | 35% | C. | 50% | D. | 75% |
分析 CO燃烧生成二氧化碳,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量;氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量.
解答 解:CO燃烧生成二氧化碳,反应方程式为2CO+O2═2CO2,二氧化碳与过氧化钠发生反应2CO2+2Na2O2=2Na2CO3+O2,方程式相加的CO+Na2O2=Na2CO3,固体增加的质量为相当于CO的质量,氢气燃烧生成水,反应方程式为2H2+O2═2H2O,水与过氧化钠发生反应2H2O+2Na2O2=4NaOH+O2,二者相加可得H2+Na2O2=2NaOH,固体增加的质量为相当于H2的质量,CO、H2、O2用电火花引燃,使其完全反应,Na2O2增重12.0g就是原混合气体中CO、H2的质量和,所以混合气体中氧气的质量为16.0g-12.0g=4g,
氧气的质量分数为:$\frac{4g}{16.0g}$×100%=25%,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握过氧化钠与水、二氧化碳反应中固体增加的实质,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
12.已知2SO2(g)+O2?2SO3(g)(正反应放热).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 在上述条件下,SO2能完全转化为SO3 | |
| C. | 反应达平衡时,SO2和SO3的浓度一定相等 | |
| D. | 反应达平衡时,正反应速率和逆反应速率一定相等 |
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 甲酸甲酯的结构简式:C2H4O2 | B. | H2O2的电子式: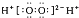 | ||
| C. | 中子数为10 的氧原子:188O | D. | 对-硝基甲苯的结构简式: |
2.如表中对于相关物质的分类全部正确的一组是( )
| 编号 | 纯净物 | 混合物 | 弱电解质 | 非电解质 |
| A | 明矾 | 铝热剂 | BaSO4 | CO2 |
| B | 氨水 | 石膏 | SO2 | CH3CH2OH |
| C | 苏打 | 氢氧化铁胶体 | H2SiO3 | NH3 |
| D | 胆矾 | 钢铁 | H2CO3 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
19.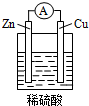 在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
 在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在如图用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片流向铜片 | |
| C. | 溶液中的阳离子向正极移动,阴离子向负极移动 | |
| D. | 电解液的PH值逐渐减少 |
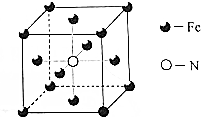 NH3可用来制尿素(
NH3可用来制尿素(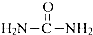 )等化学肥料.
)等化学肥料.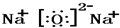 .
.