题目内容
14.某可逆反应过程的能量变化如图所示,下列说法正确的是( )
| A. | 该反应能量变化类型与CaCO3分解反应相同 | |
| B. | 加催化剂后,正反应速率加快,逆反应速率减小 | |
| C. | 若该反应为氧化还原反应,则可以将其设计成原电池 | |
| D. | 反应热△H=E2-E1 |
分析 A、当反应物的能量高于生成物的能量,反应是放热的,反之是吸热的;
B、催化剂同等程度的改变正逆反应速率;
C、若该反应为氧化还原反应,由A得出又是放热反应,所以可以将其设计成原电池;
D、反应热△H=E1-E2.
解答 解:A、从图中看出:反应物的能量高于生成物的能量,所以反应是放热的,而CaCO3分解吸热反应,故A错误;
B、催化剂同等程度的改变正逆反应速率,加入催化剂,正反应速率加快,逆反应速率也加快,故B错误;
C、从图中看出:反应物的能量高于生成物的能量,所以反应是放热的,若该反应为氧化还原反应,可以将其设计成原电池,故C正确;
D、反应热△H=E1-E2,故D错误;
故选C.
点评 本题涉及物质的能量和反应的吸放热之间的关系、催化剂的特点以及原电池的设计条件等方面的知识,属于综合知识的考查,难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
5. 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.
I.用磷矿石在高温下制备白磷(P4)的化学方程式为:2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)
(1)反应中破坏的化学键有abc.
a.离子键 b.极性共价键 c.非极性共价键
(2)白磷肯定不具有的性质是c(单项选择).
a.与强碱发生自身氧化还原反应 b.易溶于CS2
c.点燃时和氢气化合生成PH3 d.易自燃
(3)P4分子呈正四面体结构,分子中有6个P-P键,键角为600.
Ⅱ.磷酸分子结构式见图.三聚磷酸可视为三个磷酸分子之间脱去两个水分子产物,其结构式为 .
.
(5)根据上表数据,写出在溶液中少量H3PO4和NaF反应的离子方程式H3PO4+F-=H2PO4-+HF.
(6)NH3比PH3更易液化,原因可能是c(单项选择).
a.H-N键键能大于H-P键键能
b.NH3分子间范德华力大于PH3分子间范德华力
c.其它原因.
 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.I.用磷矿石在高温下制备白磷(P4)的化学方程式为:2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)
(1)反应中破坏的化学键有abc.
a.离子键 b.极性共价键 c.非极性共价键
(2)白磷肯定不具有的性质是c(单项选择).
a.与强碱发生自身氧化还原反应 b.易溶于CS2
c.点燃时和氢气化合生成PH3 d.易自燃
(3)P4分子呈正四面体结构,分子中有6个P-P键,键角为600.
Ⅱ.磷酸分子结构式见图.三聚磷酸可视为三个磷酸分子之间脱去两个水分子产物,其结构式为
 .
.| 电离常数(25℃) |
| HF:Ki=3.6×10 -4 |
| H3PO4:Ki1=7.5×10 -3, Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
(6)NH3比PH3更易液化,原因可能是c(单项选择).
a.H-N键键能大于H-P键键能
b.NH3分子间范德华力大于PH3分子间范德华力
c.其它原因.
2.反应 H2(g)+C12(g)→2HCl(g)的能量变化可用如图表示.下列说法错误的是( )


| A. | 2 mol 气态氢原子的能量低于1 mol 氢气 | |
| B. | 氢气分子中的化学键比氯气分子中的化学键更稳定 | |
| C. | 氢气与氯气反应的热化学方程式为H2(g)+C12(g)→2HCl(g)+183 kJ | |
| D. | 该反应在光照和点燃条件下的反应热效应是相同的 |
6.下列叙述正确的是( )
| A. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| B. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| C. | 一定条件下,氨基酸之间能发生反应,合成更复杂的化合物(多肽) | |
| D. | 向2ml苯中加入1ml酸性高锰酸钾溶液,振荡后静置,可观察到液体分层,上层呈紫红色 |
6.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是(填离子符号)Na+.
(3)已知:
①工业制镁时,电解MgCl2而不电解MgO的原因是MgO的熔点高,熔融时消耗更多能量,增加生产成本;
②制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电; ③写出电解Al2O3反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$+4Al+3O2↑.
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是(填离子符号)Na+.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
②制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电; ③写出电解Al2O3反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$+4Al+3O2↑.

 +HCl→
+HCl→
 $→_{一定条件}^{CH_{3}COOH}$
$→_{一定条件}^{CH_{3}COOH}$



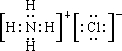 .
.