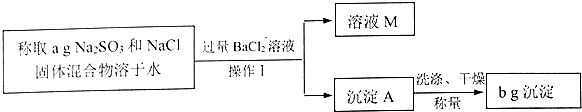
题目内容
19.已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠.某同学为探究Na2SO3溶液是否发生变质,设计如下实验测定1.0mol•L-1Na2SO3溶液的实际浓度.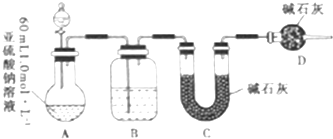
(1)分液漏斗中应加入足量的下列哪种试剂?B(填选项)
A.浓硝酸 B.65%硫酸 C.浓盐酸
(2)实验前后C装置增重3.2g,则测得Na2SO3溶液的物质的量浓度为0.83mol•L-1.
(3)该实验装置还存在一个明显的缺陷是缺少一个驱赶残留二氧化硫气体的装置.
分析 装置A中的亚硫酸钠加入浓硫酸反应生成二氧化硫气体,通过装置B中浓硫酸干燥气体,用装置C吸收二氧化硫,装置D是防止空气中的水蒸气和二氧化碳干扰二氧化硫气体质量的测定,
(1)根据浓盐酸、浓硝酸和浓硫酸的性质判断应选取的物质;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,根据二氧化硫的质量计算亚硫酸钠固体中含有的亚硫酸钠,从而计算出其浓度;
(3)二氧化硫能储存在某些装置中.
解答 解:(1)A、浓硝酸有挥发性,且浓硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子而得不到二氧化硫气体,故A错误;
B、稀硫酸的氧化性是氢元素表现,反应速率较慢,浓硫酸主要以分子存在,而亚硫酸钠和硫酸的反应是在溶液中以离子进行反应,所以用65%硫酸和亚硫酸钠固体反应制取二氧化硫,故B正确;
C、浓盐酸有挥发性,会对实验造成干扰,故C错误,
故答案为:B;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,
设亚硫酸钠的物质的量浓度为C,
H2SO4+Na2SO3=H2O+Na2SO4+SO2↑
1mol 64g
0.06Cmol 3.2g
C=0.83mol•L-1,
故答案为:0.83;
(3)二氧化硫能储存在某些装置中导致碱石灰吸收的二氧化硫减少,造成偏差,所以存在的缺陷是:缺少一个驱赶残留二氧化硫气体的装置,
故答案为:缺少一个驱赶残留二氧化硫气体的装置.
点评 本题考查了亚硫酸钠漂白性的探究实验,难度不大,注意实验室制取二氧化硫时选取的酸不能是浓盐酸、浓硝酸和98%的浓硫酸.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.元素X的单质及X与Y形成的化合物能按如图所示的关系发生转化.则X为( )


| A. | 当n=1时,X可能是C | B. | 当n=1时,X可能是Al | ||
| C. | 当n=2时,X可能是S | D. | 当n=2时,X可能是Na |
10.下列指定反应的离子方程式正确的是( )
| A. | 向稀HNO3中滴加Na2SO3溶液:2H++SO32-═SO2↑+H2O | |
| B. | 向Al2(SO4)3溶液中加入过量的NaOH溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O | |
| D. | 向0.1mol/LpH=1的KHA溶液中加入KOH溶液:H++OH-═H2O |
7.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将少量某物质的溶液滴加到新制氢氧化铜中,加热 | 有红色沉淀生成 | 该物质一定属于醛类 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度小于Mg(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
14.某可逆反应过程的能量变化如图所示,下列说法正确的是( )
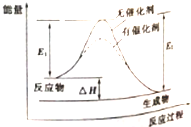

| A. | 该反应能量变化类型与CaCO3分解反应相同 | |
| B. | 加催化剂后,正反应速率加快,逆反应速率减小 | |
| C. | 若该反应为氧化还原反应,则可以将其设计成原电池 | |
| D. | 反应热△H=E2-E1 |
4.X、Y、Z是3种短周期元素,其中X、Z位于同一主族.X原子的最外层电子数是其电子层数的3倍.X原子的核外电子数比Y原子少1.下列说法正确的是( )
| A. | 原子半径由大到小的顺序为Z>X>Y | |
| B. | Z元素的氢化物是一种强酸 | |
| C. | 元素非金属性由强到弱的顺序为X>Y>Z | |
| D. | 3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
11.下列不能使有色布条褪色的物质是( )
| A. | 氯水 | B. | NaClO溶液 | C. | 漂白粉溶液 | D. | CaCl2溶液 |