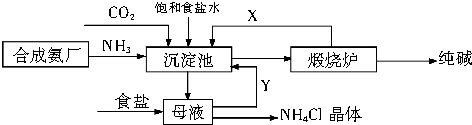
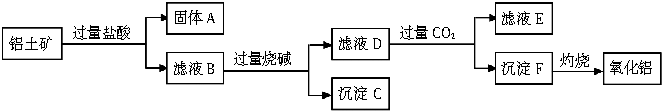
题目内容
13.对于下列反应:2SO2+O2?2SO3△H<0,如果2min内SO2的浓度由6mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为2mol/(L•min).如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0,.5mol/(L•min),那么2min时SO2的浓度为2mol/L.分析 根据v=$\frac{△c}{△t}$计算化学反应速率,根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化硫的反应速率,根据反应速率计算二氧化硫反应量,从而得出2min时SO2的浓度.
解答 解:对于下列反应:2SO2+O2?2SO3△H<0,如果2min内SO2的浓度由6mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为v=$\frac{△c}{△t}$=$\frac{6-2}{2}$mol/(L•min)=2mol/(L•min),
如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),氧气消耗浓度=0.5mol/(L•min)×2min=1mol/L,化学方程式定量计算得到消耗二氧化硫浓度为2mol/L,则二氧化硫的平衡浓度=4mol/L-1mol/L=2mol/L,
故答案为:2mol/(L•min);2mol/L.
点评 本题考查化学反应速率概念理解和计算应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
3.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | X的原子序数比Y的小 | B. | X的原子半径比Y的大 | ||
| C. | X原子的最外层电子数比Y的大 | D. | X元素的最高正价比Y的大 |
1.下列离子方程式中书写正确的是( )
| A. | 碳酸氢铵溶液与足量的氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 氯化铝溶液显酸性:Al3++3H2O?Al(OH)3↓+3H + |
8.0.1 mol.L-1KHS溶液中下列表达式不正确的是( )
| A. | c(K+)+c(H+)=c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(S2-)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
18.按照物质的树状分类和交叉分类,HNO3应属于A( )
①酸
②氧化物
③含氧酸
④一元酸
⑤电解质
⑥混合物
⑦无机化合物.
①酸
②氧化物
③含氧酸
④一元酸
⑤电解质
⑥混合物
⑦无机化合物.
| A. | ①②③④⑤⑦ | B. | ①④⑥⑦ | C. | ①②③④⑥ | D. | ①③④⑤⑦ |