题目内容
7.下列关于有机物的叙述中有( )句话是正确的.①福尔马林、酒精均可使蛋白质变性
②石油的炼制过程不都是化学变化
③麦芽糖、淀粉水解的最终产物均为葡萄糖
④甲烷分子的比例模型:

⑤天然气和石蜡的主要成分都是碳氢化合物
⑥用饱和氢氧化钠溶液除去乙酸乙酯中的少量乙酸
⑦煤的液化和气化是物理变化
⑧苯和乙烯两种物质均能使溴水和酸性高锰酸钾溶液褪色,且反应类型也相同.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
分析 ①福尔马林、酒精均可使蛋白质发生变性;
②石油的分馏为物理变化;
③麦芽糖、淀粉的水解产物为葡萄糖;
④甲烷形成4个C-H键,为正四面体;
⑤天然气和石蜡的主要成分都是烃;
⑥饱和碳酸钠溶液与乙酸反应,降低乙酸乙酯的溶解度;
⑦煤的液化和气化为化学变化;
⑧苯与高锰酸钾不反应.
解答 解:①福尔马林、苯酚、酒精均可使蛋白质发生变性,均可用于消毒,故正确;
②石油的分馏为物理变化,根据物质的沸点进行分离,故正确;
③麦芽糖、淀粉的水解产物为葡萄糖,故正确;
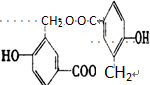
④甲烷形成4个C-H键,为正四面体,比例模型为 ,故正确;
,故正确;
⑤天然气和石蜡的主要成分都是烃,都是碳氢化合物,故正确;
⑥饱和碳酸钠溶液与乙酸反应,降低乙酸乙酯的溶解度,而氢氧化钠可使乙酸乙酯水解,故错误;
⑦煤的液化和气化为化学变化,故错误;
⑧苯性质稳定,与高锰酸钾不反应,故错误.
故选C.
点评 本题考查较综合,侧重有机物结构与性质的考查,把握有机物官能团与性质的关系为解答的关键,注意有机反应、有机物除杂、性质与用途的分析,题目难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
11.等质量下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
| A. | Fe2O3 | B. | FeSO4 | C. | Cu | D. | CuO |
18.下列化学用语表示正确的是( )
| A. | 氯化氢的电子式: | B. | 甲烷的比例模型: | ||
| C. | 水分子的结构式:H-O-H | D. | 氯原子的结构示意图: |
15.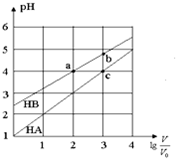 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随$lg\frac{V}{V_0}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| C. | 溶液中水的电离程度:a=c>b | |
| D. | 当$lg\frac{V}{V_0}=3$时,若两溶液同时升高温度,则$\frac{{c({B^-})}}{{c({A^-})}}$减小 |
2.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 金属钠、电石着火时,直接用高压水枪喷水扑灭 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 家庭中洁厕灵与“84消毒液”不能同时使用 |
12.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
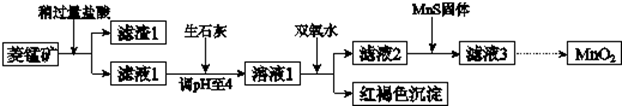
已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率;盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).

已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率;盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O;
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS;
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+4H2O=Cl2↑+5MnO2+8H+;
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+;
②若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度[或增大c(Mn2+)/c(Cl-)],有利于Mn2+放电(不利于Cl-放电).
19.下列有关叙述正确的是( )
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | 弱电解质溶液的导电能力一定比强电解质溶液的弱 | |
| C. | SO2溶于水,其水溶液能导电,故SO2是电解质 | |
| D. | 蔗糖、碳酸钙和水分别属于非电解质、强电解质和弱电解质 |
17.为了检验和除去表中的各种杂质(括号里的物质为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内.
①检验的试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:CH2=CH2+Br2→BrCH2CH2Br.
| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | B | d |
| 酒 精(水) | A | c |
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.水 D.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜 b.乙酸 c.新制的生石灰 d.溴水
③写出除杂时,乙烯发生反应的化学方程式:CH2=CH2+Br2→BrCH2CH2Br.
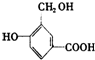 的结构回答下列问题:
的结构回答下列问题: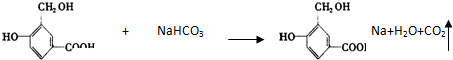
 .
.