题目内容
下列反应的离子方程式正确的是( )
| A、氧化铜与硫酸混合:O2-+2H+=H2O |
| B、澄清的石灰水跟盐酸反应:Ca2++2Cl-=CaCl2 |
| C、Fe和盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、石灰石和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O |
考点:离子方程式的书写
专题:
分析:A.氧化铜为难溶的氧化物,离子方程式中不能拆开,需要保留化学式;
B.氯化钙为易溶物,氢氧化钙与盐酸反应的实质为氢离子与氢氧根离子反应生成水;
C.铁与盐酸反应生成氯化亚铁,不是生成氯化铁;
D.石灰石的主要成分为碳酸钙,碳酸钙与盐酸反应生成氯化钙、二氧化碳和水.
B.氯化钙为易溶物,氢氧化钙与盐酸反应的实质为氢离子与氢氧根离子反应生成水;
C.铁与盐酸反应生成氯化亚铁,不是生成氯化铁;
D.石灰石的主要成分为碳酸钙,碳酸钙与盐酸反应生成氯化钙、二氧化碳和水.
解答:
解:A.氧化铜不能拆开,氧化铜与硫酸混合的离子反应为:CuO+2H+═Cu2++H2O,故A错误;
B.澄清的石灰水跟盐酸反应的实质为氢离子与氢氧根离子反应生成水,正确的离子方程式为:OH-+H+═H2O,故B错误;
C.铁与盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;
D.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D正确;
故选D.
B.澄清的石灰水跟盐酸反应的实质为氢离子与氢氧根离子反应生成水,正确的离子方程式为:OH-+H+═H2O,故B错误;
C.铁与盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+=Fe2++H2↑,故C错误;
D.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D正确;
故选D.
点评:本题考查了离子方程式的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
下列的离子方程式书写不正确的是( )
| A、硫酸与氯化钡反应:SO42-+Ba2+=BaSO4↓ |
| B、碳酸钙放入稀盐酸中:CO32-+2H+=CO2↑+H2O |
| C、稀硫酸滴在锌片上:Zn+2H+=Zn2++H2↑ |
| D、CuO和盐酸反应:CuO+2H+=Cu2++H2O |
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7 mol?L-1 |
| C、将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(S2-)+2c(HS-)+3c(H2S) |
| D、将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3?H2O)>c(OH-)>c(H+) |
16O中的16表示的含义是( )
| A、氧元素的相对原子质量 |
| B、氧元素的一种同位素的近似相对原子质量 |
| C、氧元素的近似相对原子质量 |
| D、氧元素的一种同位素的质量数 |
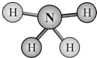 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )
肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料.查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如图所示.下列说法不正确的是( )| A、肼分子中的氮原子采用sp3杂化 |
| B、肼分子中既有极性键又有非极性键 |
| C、肼分子是非极性分子 |
| D、肼与偏二甲肼互称同系物 |
下列离子方程式书写正确的是( )
| A、将铁放入氯化铁溶液中:Fe+Fe3+═2Fe2+ |
| B、向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、将少量的二氧化硫通入氢氧化钠溶液中:SO2+2OH-═SO32-+H2O |
| D、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
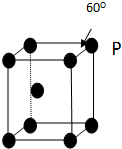 A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.
A、B、C、D、E五种元素其核电荷数依次增大.A原子只有1个s电子,B原子L层中s电子和p电子数目相同,B、C、D属于同周期且相邻,E原子内层均饱和,N层上只有两个电子.
