题目内容
8.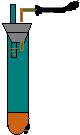 如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:
如图所示,向小试管中加入约3毫升饱和CuSO4溶液,再用胶头滴管沿试管壁小心地缓慢滴入 2 毫升浓H2SO4,静止片刻,请将观察到的现象填在空白处:(1)波形试管中左液面下降,右液面上升.
(A) 下降,上升. (B) 上升,下降.
(C) 下降,不变. (D) 不变,下降.
(2)试管中液体分为两层,上层呈蓝色,下层呈无色.
(A) 上层蓝色,下层红色. (B) 上层红色,下层无色.
(C) 上层蓝色,下层无色. (D) 上层无色,下层蓝色.
(3)若在下层溶液中有白色固体沉降出来,则发生反应的化学方程式为:
CuSO4•5H2O $\frac{\underline{\;\;△\;\;}}{\;}$CoSO4+5H2O
请判断:对
(4)若在下层溶液中有蓝色晶体析出,则此蓝色晶体的分子式为:CuSO4.
请判断:错.
分析 浓硫酸的密度比水的密度大,溶于水放出大量热,试管内压强增大,且浓硫酸具有强吸水性和脱水性,必将导致从饱和硫酸铜溶液中析出白色CuSO4固体.
解答 解:(1)浓硫酸溶于水放出大量热,使试管内密闭的气体受热膨胀,从而导致U形细管内左边液面下降,右边液面升高,
故答案为:A;
(2)浓硫酸的密度比饱和硫酸铜溶液的密度大,沿小试管的内壁小心地慢慢倒入的浓硫酸会沉在底部,上层为蓝色硫酸铜,下层为无色浓硫酸;
故答案为:C;
(3)浓硫酸具有吸水性,无水硫酸铜为蓝色,去掉水后生成白色的硫酸铜,发生反应的化学方程式为:
CuSO4•5H2O $\frac{\underline{\;\;△\;\;}}{\;}$CoSO4+5H2O,
故答案为:对;
(4)硫酸铜为白色固体,五水硫酸铜为蓝色晶体,蓝色晶体的分子式为:CuSO4•5H2O;
故答案为:错误.
点评 本题考查了元素化合物知识,明确浓硫酸溶解时放热及具有吸水性是解题关键,注意熟记硫酸铜与五水硫酸铜颜色,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
19.下列溶液中离子或分子有可能大量共存的是( )
| A. | 由水电离出的c(H )═10-13mol/L 溶液:Mg2+、Cu2+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、NH4+、Cl-、S2- | |
| C. | 高锰酸钾溶液:Fe3+、H+、SO42-、C2H5OH | |
| D. | 中性溶液中:Fe3+、K+、Cl-、SO42- |
16.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 常温常压下,2gD2O中含有的电子总数为NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
20.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 1mol铁与足量的盐酸反应转移电子数为2 NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
17.下列现象与氢键有关的是( )
①HF的熔、沸点比VⅡA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④氨气极易溶于水
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定.
①HF的熔、沸点比VⅡA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④氨气极易溶于水
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
18.下列离子方程式错误的是( )
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |