题目内容
15.利用人工光合作用合成甲酸的原理为2CO2+2H2O?2HCOOH+O2,装置如图所示,下列说法不正确的是( )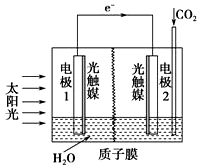
| A. | 该装置将太阳能转化为化学能和电能 | |
| B. | 电极1周围pH减小 | |
| C. | 电极2上发生的反应为CO2+2H++2e-═HCOOH | |
| D. | H+由电极2室经过质子膜流向电极1室 |
分析 由电子转移的方向可知,电极1为负极,水失电子发生氧化反应生成氧气与氢离子,电极2为正极,发生还原反应,右室通入二氧化碳,酸性条件下生成HCOOH,以此解答该题.
解答 解:A.过程中是光合作用,太阳能转化为化学能,且有电流产生,太阳能转化为电能,故A正确;
B.电极1是负极,发生氧化反应生成氧气与氢离子,pH减小,故B正确;
C.在电极2通入二氧化碳,酸性条件下生成HCOOH,电极反应为CO2+2H++2e-═HCOOH,故C正确;
D.原电池工作时,阳离子向正极移动,则H+由电极1室经过质子膜流向电极2,故D错误;
故选D.
点评 本题考查原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
相关题目
5.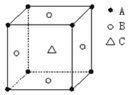 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
 某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为( )| A. | 1:2:1 | B. | 1:3:1 | C. | 2:2:1 | D. | 1:3:3 |
6.下列物质放入水中,会显著放热的是( )
| A. | 生石灰 | B. | 硝酸铵 | C. | 氯化钠 | D. | 蔗糖 |
3.下列反应过程中的能量变化情况符合如图的是( )


| A. | 石灰石高温分解反应 | B. | 镁和盐酸的反应 | ||
| C. | 酸与碱的中和反应 | D. | 氧化钙和水的反应 |
10. 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料.有关说法正确的是( )| A. | 合金的熔点通常比组分金属高,硬度比组分金属小 | |
| B. | 已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2 | |
| C. | 用金属铝与V2O5反应冶炼钒,铝作还原剂 | |
| D. | V原子序数为23,该原子的价电子构型为4S24P1 |
20.表是元素周期表的一部分,回答下列有关问题:
(1)写出元素符号:⑨Ar(填化学式,下同)
(2)在这些元素中,最活泼的金属元素是K.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.
5.下列离子方程式表达正确的是( )
| A. | Na2S的水解:S2ˉ+2H2O?H2S+2OHˉ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| D. | 向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO |
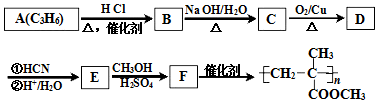
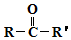 $→_{②H+/H_{2}O}^{①HCN}$
$→_{②H+/H_{2}O}^{①HCN}$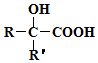 (R'可以是烃基,也可以是H原子)
(R'可以是烃基,也可以是H原子)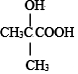 ,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为
,2分子E在浓硫酸、加热的条件下可以生成一种含六元环的化合物,该化合物的结构简式为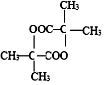 .
. )的合成路线(无机试剂可以任选)
)的合成路线(无机试剂可以任选)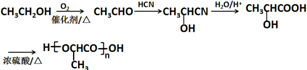 .
.