题目内容
15.将8.7gMnO2固体和5.85g食盐混合,再加入过量浓硫酸加热可放出气体,该气体与过量KI反应,生成的I2用Na2S2O3溶液吸收:I2+2Na2S2O3→2NaI+Na2S4O6,若要将生成的I2全部吸收,则需1mol/L的Na2S2O3溶液( )| A. | 50mL | B. | 33.3mL | C. | 100mL | D. | 66.7mL |
分析 浓硫酸足量,则生成氯气的反应为MnO2+2NaCl+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+Na2SO4+2H2O+Cl2↑,先判断二氧化锰和食盐的过量情况,根据不足量计算出生成氯气的物质的量,然后可计算出生成碘单质的物质的量,再结合反应方程式计算出需要Na2S2O3的物质的量,最后根据V=$\frac{n}{c}$计算出需要1mol/L的Na2S2O3溶液的体积.
解答 解:发生反应为:MnO2+2NaCl+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnSO4+Na2SO4+2H2O+Cl2↑,
87 117
8.7g 11.7g
说明食盐不足,生成氯气的量需要氨气氯化钠的质量计算,根据Cl元素守恒可知生成氯气的物质的量为:n(Cl2)=$\frac{1}{2}$n(NaCl)=$\frac{5.85g}{58.5g/mol}$×$\frac{1}{2}$=0.05mol,
0.05mol氯气与与过量KI反应,生成的I2的物质的量为0.05mol,
根据反应I2+2Na2S2O3→2NaI+Na2S4O6可知,0.05mol I2完全反应消耗Na2S2O3的物质的量为:n(Na2S2O3)=2n(I2)=0.05mol×2=0.1mol,
则需要1mol/L的Na2S2O3溶液的体积为:$\frac{0.1mol}{1mol/L}$=0.1L=100mL,
故选C.
点评 本题考查了化学方程式的计算,题目难度中等,根据反应物过量情况正确计算生成氯气的量为解答关键,注意掌握发生反应原理,试题培养了学生的分析能力及化学计算能力.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 可用量筒量取16.28mL的浓硫酸 | |
| B. | 用托盘天平准确称取2.00g的NaOH固体 | |
| C. | 常温常压下1molO2的质量为32g | |
| D. | 用250mL的容量瓶配制30%的NaCl溶液 |
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则H2的平均反应速率v(H2)为0.125mol/(L•min);.
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有C(填序号).
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1
B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定
D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,对平衡体系产生的影响是CD(填字母序号).
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是AC(填序号).
A.Q1+Q2=a
B.α3<α1
C.P3<2P1=2P2
D.n2<n3<1.0mol
(6)已知:①3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-24kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ•mol-1
2H2(g)+CO(g)?CH3OH(g);△H=-a KJ•mol-1,则 a=91.
| 选项 | 化学反应及离子方程式 | 评价 |
| A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++2H2O | 碱性氧化物与酸反应生成盐和水,正确 |
| B | 向亚硫酸氨溶液中加入少量氢氧化钡溶液 Ba2++SO32-=BaSO3↓ | 复分解反应,有沉淀生成,正确 |
| C | 含n mol FeBr2的溶液中通入n mol Cl2完全反应2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
| D | 三氯化铁溶液滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
| A. | A | B. | B | C. | C | D. | D |
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法不正确的是( )| A. | a点:由水电离出的c(H+)>1.0×10-14mol•L-1 | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | c点:c(Cl-)>c(NH4+) | |
| D. | d点后,溶液温度略下降的主要原因不可能是NH3•H2O电离吸热 |
| A. | A元素形成的双原子分子A2最多有3种 | |
| B. | 化合物BC2的电子式为 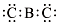 | |
| C. | B、C、D三种元素的非金属性强弱顺序为C>D>B | |
| D. | 化合物A2C的沸点高于A2D是因为C-A键比D-A键稳定 |
 A.B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).
A.B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去).