题目内容
19.下列关于物质的相互关系正确的是( )| A. | ${\;}_{\;}^{12}C$ 与${\;}_{\;}^{14}C$互为同素异形体 | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 二甲醚与乙醇互为同分异构体 | |
| D. | 乙烷与乙烯互为同系物 |
分析 A.同素异形体是同种元素形成的不同单质,同素异形体首先是单质,其次是同种元素;
B.质子数相同中子数不同的原子互称同位素.互为同位素原子具有以下特征:质子数相同、化学性质相同、在周期表中的位置相同;中子数不同、质量数不同、物理性质不同;研究对象为原子;
C.具有相同分子式而结构不同的化合物互为同分异构体;
D.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.互为同系物物质具有以下特点:结构相似、化学性质相似、分子式通式相同;分子式不同、物理性质不同;研究对象是有机物.
解答 解:A.${\;}_{\;}^{12}C$ 与${\;}_{\;}^{14}C$是原子,不是单质,故A错误;
B.金刚石与石墨互是单质,不是原子,故B错误;
C.二甲醚与乙醇分子式相同,结构不同,互为同分异构体,故C正确;
D.乙烷是烷烃,乙烯含碳碳双键,结构不相似,不为同系物,故D错误.
故选C.
点评 本题考查化学“四同”,题目难度不大,注意把握概念的理解和“四同”间的异同是解决此类题的关键之所在.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.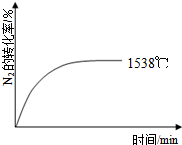 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
①该反应的△H>0.(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.(1)反应需要在闪电或极高温条件下发生,说明该反应A.(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
②其他条件相同时,在上述三个温度下分别发生该反应.1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图.
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是AE.
A.降低温度 B.加催化剂 C.增加压强
D.增加O2浓度 E.分离出一氧化氮
(4)NO在科学界被誉为“明星分子”,用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂.已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气).
且:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
请写出肼与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
10.下列除去杂质的方法错误的是( )
| A. | 除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤 | |
| C. | 除去Na2CO3固体中的NaHCO3:加热至恒重 | |
| D. | 除去CO2中混有的HCl:将气体通过饱和Na2CO3溶液 |
7.下列关于乙醇的说法正确的是( )
| A. | 难溶于水 | B. | 是一种无色无味液体 | ||
| C. | 能发生酯化反应 | D. | 存在官能团叫羧基 |
14.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是( )
| A. | 植物油是高分子化合物 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生水解和氧化反应 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
4.如图是某有机物分子的比例模型,有关该物质的推断不正确的是( )


| A. | 该物质可以与碳酸氢钠反应产生气体 | |
| B. | 该物质可以发生酯化反应 | |
| C. | 此分子应该为某种氨基酸 | |
| D. | 该物质的分子式C3H6O3 |
11.下列关于钠及其化合物的叙述错误的是?( )
| A. | 取用金属钠时,所需用品至少有小刀、镊子、滤纸、玻璃片 | |
| B. | 金属钠与Ca(HCO3)2溶液反应时,既有白色沉淀又有气体逸出 | |
| C. | 生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl | |
| D. | Na2O2与碱反应生成盐和水,所以Na2O2是碱性氧化物 |
8.铅蓄电池放电时的反应:PbO2+Pb+2H2SO4═2PbSO4+2H2O,下列有关放电时的说法正确的是( )
| A. | PbO2作正极,电极发生氧化反应 | |
| B. | 当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g | |
| C. | 负极的电极反应式是:Pb+SO42--2e-═PbSO4 | |
| D. | 溶液中H+移向负极 |
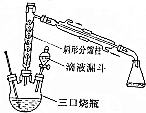
9.乙酸乙酯时重要的工业溶剂,也是生产醋酸纤维、合成药物的原料.实验室制备乙酸乙酯的反应装置示意图和有关数据如下:
实验步骤:
①在三颈烧瓶中,加入10mL乙醇,在振摇下分次加入10mL浓硫酸,混合均匀,加入几粒沸石,按图示装配好各仪器.
②在沙浴小心加热三颈烧瓶,反应温度约为110℃.
③将20mL冰醋酸与20mL乙醇的混合物由液滴漏斗滴入三颈烧瓶中.
④把收集到的溶液用20mL2mol•L-1碳酸钠溶液洗涤2~3次,再用水洗涤.
⑤分液,上面酯层倒入干燥的50mL锥形瓶中,加适量无水硫酸镁,加塞,放置,过滤,得乙酸乙酯粗品.回
答下列问题:
(1)装置中分馏柱的作用是冷凝回流;加入沸石的目的是防止爆沸.
(2)该实验为了提高乙酸的转化率和乙酸乙酯和产率,可采取的措施有使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量等(填字母).
 | 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水的溶解性 |
| 乙醇 | 46 | 0.789 | 78.3 | 溶 | |
| 乙酸 | 60 | 1.050 | 117.9 | 溶 | |
| 乙酸乙酯 | 88 | 0.896 | 77.2 | 不溶 |
①在三颈烧瓶中,加入10mL乙醇,在振摇下分次加入10mL浓硫酸,混合均匀,加入几粒沸石,按图示装配好各仪器.
②在沙浴小心加热三颈烧瓶,反应温度约为110℃.
③将20mL冰醋酸与20mL乙醇的混合物由液滴漏斗滴入三颈烧瓶中.
④把收集到的溶液用20mL2mol•L-1碳酸钠溶液洗涤2~3次,再用水洗涤.
⑤分液,上面酯层倒入干燥的50mL锥形瓶中,加适量无水硫酸镁,加塞,放置,过滤,得乙酸乙酯粗品.回
答下列问题:
(1)装置中分馏柱的作用是冷凝回流;加入沸石的目的是防止爆沸.
(2)该实验为了提高乙酸的转化率和乙酸乙酯和产率,可采取的措施有使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量等(填字母).