题目内容
7.下列说法正确的是( )①NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
②含有共价键的晶体一定具有高的熔、沸点及硬度
③s-s σ键与s-p σ键的电子云形状相同
④含有π键的化合物与只含σ键的化合物的化学性质不同
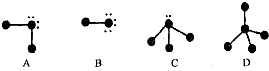
⑤中心原子采取sp3杂化的分子,其立体构形不一定是正四面体
⑥配位键在形成时,是由成键双方各提供一个电子形成共用电子对.
| A. | ①②⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ②③⑥ |
分析 ①与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置;
②含有共价键的晶体可能为分子晶体或原子晶体;
③s-s σ键与s-p σ键的电子云形状不同;
④π键和σ键的活泼性不同导致物质的化学性质不同;
⑤中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体;
⑥配位键中单方提供孤电子对.
解答 解:①NaCl晶体中与每个Na+距离相等且最近的Na+个数=3×8×$\frac{1}{2}$=12,故正确;
②含有共价键的晶体可能为分子晶体或原子晶体,如为分子晶体,则熔、沸点及硬度较低,故错误;
③S能级电子云是球形,P能级电子云是哑铃型,所以s-s σ键与s-p σ键的电子云形状不同,故错误;
④π键和σ键的活泼性不同导致物质的化学性质不同,含有π键的物质性质较活泼,故正确;
⑤中心原子采取sp3杂化的分子,VSEPR模型是正四面体,但其立体构形不一定是正四面体,如:水和氨气分子中中心原子采取sp3杂化,但H2O是V型,NH3是三角锥型,故正确;
⑥配位键中单方提供孤电子对,不是双方提供电子,故错误.
故选B.
点评 本题考查的知识点较综合,为高频考点,侧重于学生的分析能力的考查,离子晶体中离子配位数的判断是学习的难点,明确离子晶体中配位数的判断及分子晶体中原子的杂化类型是高考的热点,要重点掌握.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目
18.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似.由此可推测BeCl2( )
| A. | 熔融不导电 | B. | 水溶液不导电 | ||
| C. | 熔点比BeBr2高 | D. | 不与NaOH溶液反应 |
15.在一定温度下,溶剂不变的密闭容器中发生反应A(g)+B(s)?C(g)+D(g),下列不能说明该可逆反应已经达到平衡状态的是( )
| A. | 混合气体压强不再发生变化 | |
| B. | 混合气体质量不再发生变化 | |
| C. | A的物质的量浓度不变 | |
| D. | 单位时间里生成C(g)和D(g)的物质的量相等 |
12.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D导线C;③A、C用导线相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D用导线相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应.据此,判断四种金属的活动性顺序是( )
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>D>B | D. | C>B>D>A |
2.下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A. | 原子序数X>Y>Z>W | B. | 纯净的X与纯净的Z反应生成XZ3 | ||
| C. | Z的最高正价为+6 | D. | HW是热稳定性最强的氢化物 |
 ;
;