题目内容
5.下列关于分散系的叙述中错误的是( )| A. | 当光束通过下列分散系:有尘埃的空气、豆浆、墨水都能观察到丁达尔效应 | |
| B. | 溶液、胶体、浊液的根本区别是分散质微粒直径的大小 | |
| C. | 把1mL0.1mol/L三氯化铁溶液滴加入20mL沸水中,边加边振荡,可制得氢氧化铁胶体 | |
| D. | 胶体的稳定性介于溶液和浊液之间,属于介稳体系 |
分析 A.分散系分为溶液、胶体、浊液.丁达尔效应是指:当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路.丁达尔现象是胶体特有的性质;
B.分散质微粒直径的大小是溶液、胶体、浊液的根本区别;
C.将氯化铁饱和溶液逐滴加入沸水中,制得氢氧化铁胶体溶液;
D.胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm.
解答 解:A.有尘埃的空气,属于胶体分散系,具有丁达尔现象,豆浆是胶体,有丁达尔效应,墨水是胶体,具有丁达尔效应,故A正确;
B.溶液、胶体、浊液的根本区别是分散质微粒直径的大小,分散质微粒直径为1-100nm的分散系为胶体,小于1nm的分散系为溶液,大于100nm的分散系为浊液,故B正确;
C.将氯化铁饱和溶液逐滴加入沸水中,继续加热至呈红褐色,制得氢氧化铁胶体溶液,不能振荡,故C错误;
D.胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm,分散质直径越大,越不稳定,所以胶体是介于溶液和浊液之间的在一定条件下能稳定存在的介稳体系,故C正确.
故选C.
点评 本题考查了胶体性质分析判断、胶体概念的理解,掌握基础是解题关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表
(1)上述反应在第5s时,NO的转化率为65%.
(2)如图1表示NO2变化曲线的是b.(填字母).
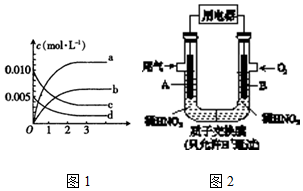
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
e.等温等容时,充入氦气 f.等温等压时充入氦气
(4)若将2mol NO和1mol O2充入两个密闭容器中,保持一定温度进行反应:2NO(g)+O2(g)?2NO2(g),在恒压条件下达到平衡时生成amol NO2,在恒容条件下达到平衡时生成bmol NO2,则a、b的关系是:a>b
(5)某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如下图2所示,其中A、B为多孔材料.下列说法正确的是D
A.电解质溶液中电流的方向由B到A,电子的流向与之相反
B.该电池工作时,每转移4mol电子,消耗22.4L O2
C.电极B附近的c(NO3-)增大
D.电极A表面反应之一为NO-3e-+2H2O═NO3-+4H+.
| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图1表示NO2变化曲线的是b.(填字母).

(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
e.等温等容时,充入氦气 f.等温等压时充入氦气
(4)若将2mol NO和1mol O2充入两个密闭容器中,保持一定温度进行反应:2NO(g)+O2(g)?2NO2(g),在恒压条件下达到平衡时生成amol NO2,在恒容条件下达到平衡时生成bmol NO2,则a、b的关系是:a>b
(5)某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如下图2所示,其中A、B为多孔材料.下列说法正确的是D
A.电解质溶液中电流的方向由B到A,电子的流向与之相反
B.该电池工作时,每转移4mol电子,消耗22.4L O2
C.电极B附近的c(NO3-)增大
D.电极A表面反应之一为NO-3e-+2H2O═NO3-+4H+.
16.汽车尾气是造成雾霾天气的重要原因之一,尾气中的主要污染物为CxHy、NO、CO、SO2及固体颗粒物等.研究汽车尾气的成分及其发生的反应,可以为更好的治理汽车尾气提供技术支持.
请回答下列问题:
(1)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如表:
根据上表数据,写出容器中发生反应的化学方程式C+2NO?N2+CO2并判断p>3.93MPa(用“>”、“<“或“=”填空).计算反应体系在200℃时的平衡常数Kp=$\frac{9}{16}$(用平衡分压代替平衡浓度计算,分压=总压×体积分数).
(2)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(3)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H2O(1)═CO(g)+3H2 (g)△H=+250.1kJ/mol.已知CO(g)、H2 (g)的燃烧热依次为283.0kJ/mol、285.8kJ/mol,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.3kW•h•kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×106J).
请回答下列问题:
(1)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000molNO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如表:
| 活性炭/mol | NO/mol | A/mol | B/mol | ρ/Mpa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 | ρ |
(2)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(3)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H2O(1)═CO(g)+3H2 (g)△H=+250.1kJ/mol.已知CO(g)、H2 (g)的燃烧热依次为283.0kJ/mol、285.8kJ/mol,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2SO4作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.3kW•h•kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×106J).
13.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ•mol-1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )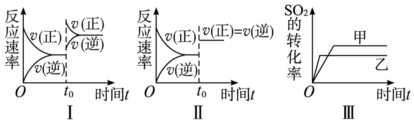

| A. | 图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响 | |
| B. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低 | |
| C. | 图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高 | |
| D. | 图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响 |
10.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | △H>0表示产物的总能量低于反应物的总能量 | |
| C. | △H 的单位kJ•mol-1,热量Q的单位为kJ | |
| D. | 化学键断裂过程中释放能量 |
14.若1g CO2中含有x个原子,则阿伏加德罗常数可表示为( )
| A. | $\frac{1}{44}$ mol-1 | B. | $\frac{x}{22}$ mol-1 | C. | $\frac{3x}{44}$ mol-1 | D. | $\frac{44x}{3}$ mol-1 |