题目内容
12.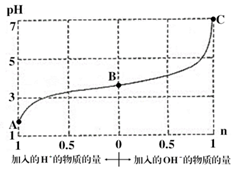 某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图.下列说法不正确的是( )
某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图.下列说法不正确的是( )| A. | A、B、C三点所表示的溶液中水的电离程度依次增大 | |
| B. | 加入1 mol NaOH后,溶液中c(Na+)=c(R-) | |
| C. | 通入HCl,R-的水解程度增大,HR的电离常数减小 | |
| D. | 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR) |
分析 A、A、B溶液呈酸性,抑制水的电离,C呈中性,以此判断;
B、加入1mol NaOH后,pH=7,溶液呈中性,结合电荷守恒判断;
C、电离平衡常数是温度的函数;
D.未加HCl和NaOH时,溶液呈酸性,说明HR的电离程度大于R-水解程度;
解答 解:A、A、B溶液呈酸性,抑制水的电离,C呈中性,pH越小,酸性越强,水的电离程度越小,则A、B、C三点所表示的溶液中水的电离程度依次增大,故A正确;
B.加入1mol NaOH后,pH=7,溶液呈中性,即(H+)=c(OH-),由电荷守恒可知c(Na+)=c(R-),故B正确;
C、电离平衡常数是温度的函数,通入氯化氢,而温度不变,所以HR的电离常数不变,故C错误;
D.未加HCl和NaOH时,溶液呈酸性,说明HR的电离程度大于R-水解程度,则B点溶液中c(R-)>c(Na+)>c(HR),故D正确;
故选C.
点评 本题考查酸碱混合的定性判断和计算,侧重于学生的分析能力和计算能力的考查,注意把握图象所给信息为解答该题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.不能与溴水发生反应的是( )
①甲苯 ②邻甲基苯酚 ③亚硫酸 ④2-丁炔 ⑤AgNO3溶液 ⑥裂化汽油 ⑦1,3-丁二烯 ⑧环己烷 ⑨葡萄糖 ⑩乙醛.
①甲苯 ②邻甲基苯酚 ③亚硫酸 ④2-丁炔 ⑤AgNO3溶液 ⑥裂化汽油 ⑦1,3-丁二烯 ⑧环己烷 ⑨葡萄糖 ⑩乙醛.
| A. | ①⑤ | B. | ①⑥⑨ | C. | ①⑧ | D. | ①②⑤⑦ |
20.下列配合物的配位数不是6的是( )
| A. | K3[Fe(SCN)6] | B. | [Cu(NH3)4]Cl2 | C. | Na3[AlF6] | D. | Na2[SiF6] |
7.下列事实能说明金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
①甲单质能与乙盐的溶液反应并置换出乙
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的最高价氧化物水化物的碱性甲大于乙
⑤两单质分别与氯气反应生成的阳离子,甲离子的化合价比乙高.
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②⑤可以 | D. | ①③④可以 |
17.W、X、Y、Z 是四种短周期非金属元素,原子序数依次增大,X、Y原子核外L电子层的电子数之比为3:4,且Y的原子半径大于X的原子半径,X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质w2.下列说法正确的是( )
| A. | 单质的沸点:X>Z | B. | X与W形成的化合物中只有极性键 | ||
| C. | 阴离子的还原性:W>X | D. | W、X、Y 可形成三元离子化合物 |
4.下列说法正确的是( )
| A. | 0.1mol/L NH4Al(SO4)2溶液中离子浓度大小关系为c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 HA(一元酸)溶液与0.1 mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)═c(OH-)+c(A-) | |
| C. | 将0.1 mol/L的醋酸溶液加水稀释的过程中,溶液里所有离子浓度都减小 | |
| D. | 向CaSO4和BaSO4沉淀共存的体系中加入少量BaCl2,溶液中c(Ca2+)减小 |
12.在水中加入等物质的量的Na+、Ag+、Pb2+和SO42-、Cl-、NO3-,然后放入惰性材料做电极的电解槽中,通电片刻,则氧化产物与还原产物的质量比为 ( )
| A. | 35.5:108 | B. | 16:207 | C. | 8:1 | D. | 108:35.5 |