题目内容
13.下列各组元素性质或原子结构的递变,叙述不正确的是( )| A. | Na、Mg、Al最高价氧化物的水化物碱性逐渐减弱 | |
| B. | P、S、Cl得电子能力依次增强 | |
| C. | Li、Na、K的密度依次增大 | |
| D. | C、N、O元素气态氢化物稳定性增强 |
分析 A.金属性越强,最高价氧化物对应水合物的碱性越强;
B.非金属性越强,得电子能力越强;
C.碱金属单质中,Na的密度大于金属钠;
D.非金属性越强,对应简单氢化物的稳定性越强.
解答 解:A.Na、Mg、Al位于同一周期,原子序数越大金属性越弱,金属性逐渐减弱,则最高价氧化物的水化物碱性逐渐减弱,故A正确;
B.P、S、Cl位于同一周期,原子序数逐渐增大,非金属性逐渐增强,则得电子能力依次增强,故B正确;
C.金属K的密度小于Na,则密度:Li<K<Na,故C错误;
D.C、N、O位于同一周期,原子半径逐渐减小,非金属性逐渐增强,则元素气态氢化物稳定性增强,故D正确;
故选C.
点评 本题考查原子结构与元素周期律的应用,题目难度不大,明确元素周期律的内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
4.下列表示2A(g)+2B(g)?2C(g)+3D(g)的反应速率最快的是( )
| A. | v(A)=0.8mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.5 mol•L-1•s-1 |
1.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
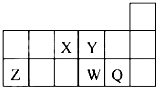

| A. | 元素X与元素Z的正化合价之和的数值等于8 | |
| B. | 原子半径的大小顺序为rX>rY>rZ>rW>rQ | |
| C. | Y和Z形成了共价化合物 | |
| D. | 元素W周期表中的位置是第三周期,第VI主族 |
8.下列说法不正确的是( )
| A. | 石墨烯和石墨互为同素异形体 | |
| B. | 乙酸和硬脂酸(C17H35COOH)互为同系物 | |
| C. | 丙烷与氯气反应,可得到沸点不同的3种一氯代物 | |
| D. | (CH3)3CCH2CH3的名称是2,2-二甲基丁烷 |
18.下面有关Fe(OH)3胶体的说法错误的是( )
| A. | Fe(OH)3胶体可用将FeCl3饱和溶液滴入沸水的方法来制备 | |
| B. | Fe(OH)3胶体电泳时,可以观察到阳极颜色加深 | |
| C. | 向 Fe(OH)3胶体中逐滴滴加稀盐酸,现象是先产生红褐色沉淀后沉淀溶解 | |
| D. | 不断搅拌Fe(OH)3胶体,溶液会变浑浊 |
5.氯碱工业中电解饱和食盐水的原理示意图如图所示(电极均为石墨电极).下列说法正确的是( )

| A. | M为电子流出的一极 | |
| B. | 通电使氯化钠发生电离 | |
| C. | 电解一段时间后,阴极区pH降低 | |
| D. | 电解时用盐酸调节阳极区的pH在2~3,有利于气体逸出 |
3.化学与人类生产、生活密切相关,下列有关说法正确的是( )
| A. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| B. | 食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物 | |
| C. | 棉花、羊毛、木材和草类的主要成分都是纤维素 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 |
 ;天然气的主要成分为CH4.(写化学式).
;天然气的主要成分为CH4.(写化学式). .
.