��Ŀ����
18��һ���¶��£���4���ݻ���Ϊ1L�������зֱ���з�Ӧ����������A��������A��s��+B��g��?C��g��+D��g����H=+100kJ/mol��ijʱ�̲�ò����������������˵����ȷ���ǣ�������| ������� | n��B��/mol | n��C��/mol | n��D��/mol | ��Ӧʱ��/min | ��Ӧ���� |
| �� | 0.06 | 0.60 | 0.10 | t1 | v������=v���棩 |
| �� | 0.12 | 1.20 | 0.20 | t2 | |
| �� | 0.32 | 1.0 | 0 | 0 | |
| �� | 0.12 | 0.30 | v������=v���棩 |
| A�� | ��������c��D��=0.4 mol/L | |
| B�� | t2ʱ��������v��������v���棩 | |
| C�� | ��������ƽ����Ӧ����v��B��=$\frac{0.04}{{t}_{1}}$mol/��L•min�� | |
| D�� | �������з�Ӧ��ƽ��ʱ����20 kJ |
���� A���������и�ʱ��v������=v���棩����Ӧ��ƽ��״̬����D��Ũ��Ϊcmol/L������ƽ�ⳣ�����㣻
B�������������֪�÷�Ӧ��ƽ�ⳣ��k=$\frac{0.6��0.1}{0.06}$=1������t2ʱ�������е�Ũ����Qc���Ƚ�Qc��K���жϷ�Ӧ���з������ж������淴Ӧ���ʹ�ϵ��
C����ʱ��v������=v���棩����Ӧ��ƽ��״̬�����ڲ�֪����Ӧ�����ĸ������ƽ�⣬����������ʵ�Ũ�ȱ仯����
D����ƽ��ʱD�����ʵ���Ϊx���ɷ���ʽ��֪��ƽ��ʱC�����ʵ���Ϊ��1+x��mol��B�����ʵ���Ϊ��3.2-x��mol������ƽ�ⳣ������x��ֵ���ٸ����Ȼ�ѧ����ʽ���㷴Ӧ���յ�������
��� �⣺A���������и�ʱ��v������=v���棩����Ӧ��ƽ��״̬����D��Ũ��Ϊcmol/L����ѧƽ�ⳣ��Ϊ������Ũ��ϵ�����ݵij˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ���¶Ȳ��䳣�����䣬�ݴ˿�֪$\frac{0.3��c}{0.12}$=$\frac{0.1��0.6}{0.06}$�����c=0.4������������c��D��=0.4 mol/L����A��ȷ��
B�������������֪�÷�Ӧ��ƽ�ⳣ��k=$\frac{0.6��0.1}{0.06}$=1��t2ʱ�������е�Ũ����Qc=$\frac{1.2��0.2}{0.12}$=2������ƽ�ⳣ��k��ƽ�����淴Ӧ�ƶ���v��������v���棩����B����
C����ʱ��v������=v���棩����Ӧ��ƽ��״̬�����ڲ�֪����Ӧ�����ĸ������ƽ�⣬���ܼ�������ʵ�Ũ�ȱ仯�������ܼ��㷴Ӧ���ʣ���C����
D����ƽ��ʱD�����ʵ���Ϊx���ɷ���ʽ��֪��ƽ��ʱC�����ʵ���Ϊ��1+x��mol��B�����ʵ���Ϊ��0.32-x��mol������ƽ�ⳣ����֪$\frac{��1+x����x}{0.32-x}$=1�����x=0.14�������Ȼ�ѧ����ʽ��֪��Ӧ���յ�����Ϊ100kJ/mol��0.14mol=14kJ����D����
��ѡA��
���� ���⿼�黯ѧ��Ӧ���ʡ���ѧƽ����㡢��ѧƽ�ⳣ����֪ʶ����Ŀ�Ѷ��еȣ�ע��A����ƽ�ⳣ���ļ��㣬Ϊ������ѵ㣮

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�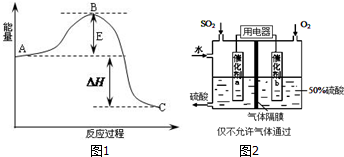
| ѹǿ/Mpa ת����/% �¶�/�� | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
��2�����Ṥ��β������ʱ��NaOH��Һ����SO2����NaHSO3����֪��0.1mol/L��NaHSO3��Һ���й���Ũ���ɴ�С��˳��Ϊc��Na+����c��HSO3-����c��SO32-����c��H2SO3��������Һ��c��H+����c��OH-�������������������=�������������ɣ��ü����ֺ����ӷ���ʽ˵������NaHSO3��Һ�д��ڷ�Ӧ��HSO3-?H++SO32-��HSO3-+H2O?OH-+H2SO3������c��SO32-����c��H2SO3�������Ե���̶ȴ���ˮ�⣮
��3�����������õ绯ѧԭ���������ᣨװ�ü�ͼ2����д��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��SO2+2H2O-2e-=SO42-+4H+��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ16��29��
| A�� | H2 | B�� | CO2 | C�� | N2 | D�� | O2 |
��Ӧ�٣�C��s��+$\frac{1}{2}$O2��g��=CO ��g����H1
��Ӧ�ڣ�C��s��+H2O��g��=CO��g��+H2��g����H2
��Ӧ�ۣ�CO��g��+2H2��g��=CH3OH��g����H 3=-90.1kJ•mol-1
��Ӧ�ܣ�2CH3OH��g��=CH3OCH3��g��+H2O��g����H 4=-134.0kJ•mol-1
��Ӧ�ݣ�3CH3OH��g��=CH3CH=CH2��g��+3H2O��g����H 5=-31.0kJ•mol-1
����˵����ȷ���ǣ�������
| A�� | ��H1-��H2��0 | |
| B�� | ��Ӧ��Ϊ���ȷ�Ӧ | |
| C�� | 3CH3OCH3��g��=2CH3CH=CH2��g��+3H2O��g����H=-103.0 kJ•mol-1 | |
| D�� | 3CO��g��+6H2��g��=CH3CH=CH2��g��+3H2O��g����H=-301.3kJ•mol-1 |
| A�� | Al3+��Na+��NO3-��Cl- | B�� | K+��Na+��Cl-��NO3- | ||
| C�� | K+��Na+��Cl-��AlO2- | D�� | K+��NH4+��SO42-��NO3- |
| A�� | þƬ������������Һ�У�Mg+2Ag+�TMg2++2Ag | |
| B�� | �����½�����ͨ��ˮ�У�Cl2+H2O?H++Cl-+HClO | |
| C�� | ������⻯����Һ��Ӧ��Cl2+I-�T2Cl-+I | |
| D�� | ����ʯ�ӵ������з�Ӧ��CO32-+2H+�TCO2��+H2O |
| A�� | ������Ӧ�����ȷ�Ӧ����AΪ��̬ | |
| B�� | ������Ӧ�Ƿ��ȷ�Ӧ����AΪ��̬ | |
| C�� | �ı�ѹǿ��ƽ����ƶ���Ӱ�� | |
| D�� | ��ƽ����ϵ�м�������C����ƽ�����淴Ӧ�����ƶ� |