题目内容
16.下列电离方程式正确的是( )| A. | H2CO3?2H++CO32- | B. | NaHSO4=Na ++HSO4- | ||
| C. | NaHCO3=Na++H++CO32- | D. | NH4Cl=NH4++Cl- |
分析 A.碳酸为二元弱酸分步电离,以第一步为主;
B.亚硫酸氢根离子为强酸的酸式根离子,水溶液中需要拆成氢离子、硫酸根离子;
C.碳酸氢根离子为弱酸的酸式根离子,不能拆;
D.氯化铵为强电解质,完全电离.
解答 解:A.碳酸为二元弱酸分步电离,以第一步为主,电离方程式:H2CO3?H++HCO3-,故A错误;
B.硫酸氢钠为强电解质,完全电离,电离方程式:NaHSO4=Na ++H++SO42-,故B错误;
C.碳酸氢钠为强电解质,完全电离,电离方程式:NaHCO3=Na++H++CO32-,故C错误;
D.氯化铵为强电解质,电离方程式:NH4Cl=NH4++Cl-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
6.现有三组溶液:①水和植物油的混合物 ②提取白酒中的乙醇 ③氯化钠和单质溴的混合液.分离以上各混合液的正确方法依次( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
7.下列溶液中Cl-的物质的量最多的是( )
| A. | 200mL 2mol/L MgCl2溶液 | B. | 150mL 5mol/L KClO3溶液 | ||
| C. | 标准状况下,13.44L的HCl气体 | D. | 29.25gNaCl固体 |
11.乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成.有关物质的物理性质见表.合成过程如下:第一步:将丁醇和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯.
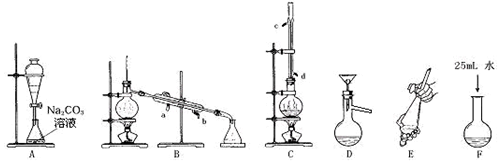
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
1.下列是我们日常生活中接触到的物质,其中属于纯净物的是( )
| A. | 蒸馏水 | B. | 可口可乐 | C. | 食醋 | D. | 洁净的空气 |
8.实验室欲配制480mL浓度为0.1mol•L-1的Na2CO3溶液,下列操作可以实现的是( )
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
5. 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
a.D中不可能是浓硫酸 b.D中可以是少量水
c.通入的氯气含有水蒸气 d.D中可以是饱和食盐水.
 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )a.D中不可能是浓硫酸 b.D中可以是少量水
c.通入的氯气含有水蒸气 d.D中可以是饱和食盐水.
| A. | abc | B. | bcd | C. | abd | D. | abcd |
20. 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①%2当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO4•7H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
制备过程中还可能存在的副反应有
2CH3CH2CH2CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式CH3CH2CH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、乙酸、正丁醇.
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为88%.
 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①%2当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO4•7H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
2CH3CH2CH2CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式CH3CH2CH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、乙酸、正丁醇.
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为88%.