题目内容
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图: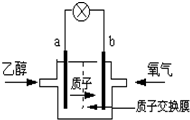
(1) 极为电池的负极,电池工作时电流方向为 (用a或b表示);
(2)写出电池负极反应方程式 ;
(3)用该燃料电池电解CuSO4溶液,则电解时发生的离子方程式为: ;若该燃料电池中有1mol乙醇被氧化时则电解池就会生成 g单质Cu.

(1)
(2)写出电池负极反应方程式
(3)用该燃料电池电解CuSO4溶液,则电解时发生的离子方程式为:
考点:原电池和电解池的工作原理
专题:
分析:(1)在燃料电池中,燃料在负极发生失电子的反应,电流在电路中从正极流向负极;
(2)在燃料电池中,负极上是乙醇失电子的氧化反应,根据电解质环境书写电极反应;
(3)电解CuSO4溶液,阳极为氢氧根失电子放出氧气,阴极为铜离子得电子析出铜单质,据此书写;根据电路中电子的转移相等计算.
(2)在燃料电池中,负极上是乙醇失电子的氧化反应,根据电解质环境书写电极反应;
(3)电解CuSO4溶液,阳极为氢氧根失电子放出氧气,阴极为铜离子得电子析出铜单质,据此书写;根据电路中电子的转移相等计算.
解答:
解:(1)在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,电流在电路中从正极流向负极,故答案为:a;由b极沿导线到a极;
(2)在燃料电池中,负极上是乙醇失电子的氧化反应,在酸性电解质环境下,负极的电极反应为C2H5OH+3H2O-12e-=2CO2+12H+,
故答案为:C2H5OH+3H2O-12e-=2CO2+12H+;
(3)电解CuSO4溶液,阳极为氢氧根失电子放出氧气,阴极为铜离子得电子析出铜单质,所以电解时发生的离子方程式为2Cu2++2H2O
2Cu+O2↑+4H+;根据电池负极反应:C2H5OH+3H2O-12e-=2CO2+12H+,反应转移电子数为12,所以1mol乙醇被氧化时就有12mol电子转移,则在阴极则析出铜
×64g/mol=384g,
故答案为:2Cu2++2H2O
2Cu+O2↑+4H+;384.
(2)在燃料电池中,负极上是乙醇失电子的氧化反应,在酸性电解质环境下,负极的电极反应为C2H5OH+3H2O-12e-=2CO2+12H+,
故答案为:C2H5OH+3H2O-12e-=2CO2+12H+;
(3)电解CuSO4溶液,阳极为氢氧根失电子放出氧气,阴极为铜离子得电子析出铜单质,所以电解时发生的离子方程式为2Cu2++2H2O
| ||
| 12mol |
| 2 |
故答案为:2Cu2++2H2O
| ||
点评:本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
在一定条件下,向密闭容器中充入30mLCO和20mL水蒸气使其反应,当CO+H2O(g)?CO2+H2达到平衡时,CO的体积分数为40%,则下列叙述错误的是( )
| A、平衡后水蒸气的体积分数与H2相等 |
| B、平衡后水的转化率为50% |
| C、平衡后CO体积与CO2相等 |
| D、平衡后CO2的体积分数为20% |
 在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g)?2NH3(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如图关系图:下列叙述正确的是( )
在容积固定的密闭容器中存在如下反应:N2(g)+3H2(g)?2NH3(g);△H<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出如图关系图:下列叙述正确的是( )| A、图Ⅰ研究的是温度对反应的影响,且甲的温度比乙高 |
| B、图Ⅱ研究的是温度对反应的影响,且甲的温度比乙高 |
| C、图Ⅱ研究的是压强对反应的影响,且甲的压强比乙大 |
| D、图Ⅲ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率比甲高 |
在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
| A、2H2(g)+O2(g)═2H2O(g)△H=-Q1 2H2(g)+O2(g)═2H2O(l)△H=-Q2 | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1 S(s)+O2(g)═SO2(g)△H=-Q2 | ||||
C、C(s)+
| ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1
|
下列有关铜锌原电池的叙述正确的是( )
| A、正极反应为Zn-2e-═Zn2+ |
| B、电池反应为Zn+Cu2+═Zn2++Cu |
| C、在外电路中,电子从正极流向负极 |
| D、取下盐桥,原电池仍可工作 |
对物质进行分类是为了更好地认识物质的共性.下列分类的依据及分类方法正确的是( )
| A、根据物质能否溶于水,将物质分为易溶物质和难溶物质 |
| B、根据化学反应中是否有单质生成把化学反应分为氧化还原反应和非氧化还原反应 |
| C、根据物质中是否含碳元素,将物质分为无机物和有机物 |
| D、根据酸中是否含有氧元素,将酸分为无氧酸和含氧酸 |
下列离子方程式正确的是( )
| A、三氯化铁溶液中加入铁Fe3++Fe═2Fe2+ |
| B、氯化镁溶液中加入硝酸银溶液Ag++Cl-═AgCl↓ |
| C、过量氯气通入溴化亚铁溶液中2Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
| D、硫化亚铁与盐酸反应 S2-+2H+═H2S↑ |
下列离子方程式正确的是( )
| A、足量氯气通入溴化亚铁溶液中:2Fe2++Cl2═2Cl-+2Fe3+ |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
| C、氨水中加入少量氯化铝溶液 Al3++4OH-=AlO2-+2H2O |
| D、H2S通入FeCl3溶液中:H2S+2Fe3+═2Fe2++S↓+2H+ |