题目内容
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料).已知:
①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4.
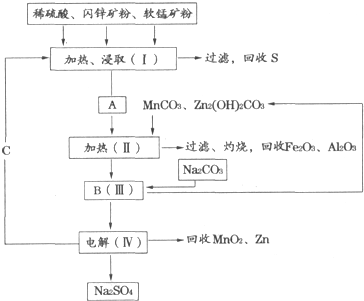
(1)A中属于还原产物的是 .
(2)MnCO3、Zn2(OH)2CO3的作用是 ;Ⅱ需要加热的原因是 ;C的化学式是 .
(3)Ⅲ中发生的离子方程式为 , ;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 .
①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为MnSO4+ZnSO4+2H2O
| ||

(1)A中属于还原产物的是
(2)MnCO3、Zn2(OH)2CO3的作用是
(3)Ⅲ中发生的离子方程式为
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:分析流程软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)加入硫酸酸溶,加热酸浸过滤得到A为A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的酸性混合液,加热过滤回收Fe2O3,Al2O3,加入碳酸钠沉淀锰离子和锌离子,得到滤液电解得到 二氧化锰、锌和硫酸钠;
(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4.
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝.Fe3+、Al3+沉淀时容易形成胶体,不利于氢氧化铁、氢氧化铝沉降.操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用.
(3)由流程可知,加入碳酸钠,反应生成MnCO3、Zn2(OH)2CO3,据此写出反应方程式;
(4)除矿石外,需加入的物质,就是要购买的化工原料.
(1)比较信息①A与软锰矿中元素化合价的变化可知,A中还原产物为MnSO4.
(2)由工艺流程可知,A中加入MnCO3、Zn2(OH)2CO3,A中的Fe3+、Al3+,经过一系列操作转化为氧化铁、氧化铝.Fe3+、Al3+沉淀时容易形成胶体,不利于氢氧化铁、氢氧化铝沉降.操作Ⅰ加热、浸取需要硫酸,由②可知C为硫酸,循环利用.
(3)由流程可知,加入碳酸钠,反应生成MnCO3、Zn2(OH)2CO3,据此写出反应方程式;
(4)除矿石外,需加入的物质,就是要购买的化工原料.
解答:
解:(1)比较信息①A与软锰矿中元素化合价的变化可知,Mn元素化合价由+4价降低为+2价,所以A中还原产物为MnSO4;
故答案为:MnSO4;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝,所以加入MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,在加热的环境下,金属阳离子的水解更彻底,更易形成沉淀而分离,根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知C为硫酸,
故答案为:增大溶液的PH,使Fe3+和Al3+均生成沉淀;促进Fe3+和Al3+的水解;H2SO4;
(3)由流程可知,B中含Mn2+、Zn2+,加入碳酸钠,反应生成MnCO3、Zn2(OH)2CO3,反应方程式为:Mn2++CO32-=MnCO3↓; 2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑;故答案为:Mn2++CO32-=MnCO3↓; 2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑;
(4)根据流程图可知,需要加入碳酸钠、硫酸,所以除矿石外,需购买的化工原料是碳酸钠、硫酸.
故答案为:纯碱、硫酸.
故答案为:MnSO4;
(2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝,所以加入MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,在加热的环境下,金属阳离子的水解更彻底,更易形成沉淀而分离,根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知C为硫酸,
故答案为:增大溶液的PH,使Fe3+和Al3+均生成沉淀;促进Fe3+和Al3+的水解;H2SO4;
(3)由流程可知,B中含Mn2+、Zn2+,加入碳酸钠,反应生成MnCO3、Zn2(OH)2CO3,反应方程式为:Mn2++CO32-=MnCO3↓; 2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑;故答案为:Mn2++CO32-=MnCO3↓; 2Zn2++2CO32-+H2O=Zn2(OH)2CO3↓+CO2↑;
(4)根据流程图可知,需要加入碳酸钠、硫酸,所以除矿石外,需购买的化工原料是碳酸钠、硫酸.
故答案为:纯碱、硫酸.
点评:本实验的目的是制备二氧化锰与锌,因而需要把氧化铝、铁元素、硫元素除去.据此考查学生对工艺流程的理解、物质性质、氧化还原反应、分离提纯基本操作,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、0.1mol?L-1的Na2CO3溶液中含CO32-为0.1NA |
| B、3.2 g O2和O3的混合气中氧原子数为0.2NA |
| C、1mol H3O+含质子数为10 NA |
| D、标准状况下,22.4 L乙醇的分子数为NA |
下列实验现象的描述不正确的是( )
| A、氢气在氯气中燃烧发出苍白色火焰,在瓶口有白雾生成 |
| B、红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟,加入少量水形成蓝色溶液 |
| C、金属Na在氯气中燃烧产生淡黄色的烟 |
| D、红热的铁丝在氯气中燃烧产生红棕色的烟 |


