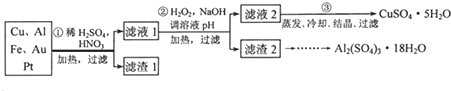
题目内容
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4?FeSO4?6H2O]比绿矾(FeSO4?7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如图1:
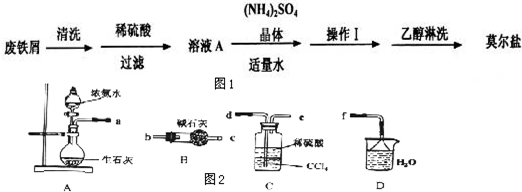
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是 ;证明溶液A不含Fe3+离子的最佳试剂是 (填序号字母).
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、 、过滤.
(2)浓度均为0.1mol?L-1盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是 .
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平 (填“左”“右”)盘.
(4)从图2装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接 ; 接 .
(5)将装置C中两种液体分离开的操作名称是 .装置D的作用是 .

(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
(2)浓度均为0.1mol?L-1盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
(4)从图2装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接
(5)将装置C中两种液体分离开的操作名称是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:废铁屑加稀硫酸溶解,得到硫酸亚铁溶液A,加硫酸铵晶体共同溶解,经过蒸发浓缩、冷却晶体、过滤、洗涤、干燥得到莫尔盐,以此分析解答;
(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;
操作I是从溶液中获得晶体,加热蒸发、冷却结晶、过滤;
(2)莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者;
(3)遵循“左物右码”原则;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收;
(5)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸.
(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;
操作I是从溶液中获得晶体,加热蒸发、冷却结晶、过滤;
(2)莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者;
(3)遵循“左物右码”原则;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收;
(5)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸.
解答:
解:废铁屑加稀硫酸溶解,得到硫酸亚铁溶液A,加硫酸铵晶体共同溶解,经过蒸发浓缩、冷却晶体、过滤、洗涤、干燥得到莫尔盐;
(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;
操作I是从溶液中获得晶体,加热蒸发、冷却结晶、过滤,
故答案为:防止Fe2+离子被氧化为Fe3+离子;b;冷却结晶;
(2)莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者,
故答案为:莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者;
(3)遵循“左物右码”原则,药品应放置在左盘内,故答案为:左;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f;故答案为:d、e、f;
(5)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸.
故答案为:分液;吸收多余的NH3防止污染空气,防止倒吸.
(1)Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子;
检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;
操作I是从溶液中获得晶体,加热蒸发、冷却结晶、过滤,
故答案为:防止Fe2+离子被氧化为Fe3+离子;b;冷却结晶;
(2)莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者,
故答案为:莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者;
(3)遵循“左物右码”原则,药品应放置在左盘内,故答案为:左;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f;故答案为:d、e、f;
(5)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸.
故答案为:分液;吸收多余的NH3防止污染空气,防止倒吸.
点评:本题考查化学工艺流程、盐类水解、化学实验等,难度中等,需要学生具有扎实的基础与运用知识分析解决问题的能力,注意基础知识的理解掌握.

练习册系列答案
相关题目
如图表示1~18号元素原子的结构或性质随核电荷数递增的变化.图中纵坐标表示( )

| A、最外层电子数 | B、原子半径 |
| C、最高化合价 | D、电子层数 |
发现了电子,并提出了“葡萄干面包式”的原子模型的科学家是( )
| A、玻尔 | B、道尔顿 |
| C、汤姆生 | D、卢瑟福 |
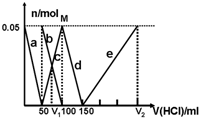 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、M点时生成的CO2为0 mol |
| B、V1:V2=1:4 |
| C、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
取a g某物质在氧气中完全燃烧(产物均为水和二氧化碳),将其产物跟足量的过氧化钠固体反应,反应后固体的质量恰好也增加了a g,下列物质中不能满足上述结果的是( )
| A、H2和CO的混合物 |
| B、CH2O2 |
| C、HCHO |
| D、CH4 |
下列电离方程式中,正确的是( )
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++OH2- |
| C、Ca(NO3)2=Ca2++2(NO3)2- |
| D、Al2(SO4)3=2Al3++3SO42- |