题目内容
CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大.
①在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大.
考点:化学平衡的影响因素
专题:化学平衡专题
分析:CO(g)+2H2(g)?CH3OH(g)△H<0;
化学平衡的标志是正逆反应速率相等,当正反应速率大于逆反应速率时,说明反应是正向进行的;反应物的体积分数和改变的影响条件有关,平衡可能逆向或正向进行;平衡常数随温度变化,不随浓度、压强改变;
化学平衡的标志是正逆反应速率相等,当正反应速率大于逆反应速率时,说明反应是正向进行的;反应物的体积分数和改变的影响条件有关,平衡可能逆向或正向进行;平衡常数随温度变化,不随浓度、压强改变;
解答:
解:化学平衡的标志是正逆反应速率相等,当正反应速率大于逆反应速率时,说明反应是正向进行的,CO(g)+2H2(g)?CH3OH(g)△H<0;
A.逆反应速率先增大后减小,说明反应逆向进行,故A错误;
B.正反应速率先增大后减小,说明反应正向进行,故B正确;
C.反应物的体积百分含量减小,可能逆向进行,也可能正向进行,不能说明反应正向进行,故C错误;
D.化学平衡常数K值增大,说明平衡正向进行,故D正确;
故答案为:BD;
A.逆反应速率先增大后减小,说明反应逆向进行,故A错误;
B.正反应速率先增大后减小,说明反应正向进行,故B正确;
C.反应物的体积百分含量减小,可能逆向进行,也可能正向进行,不能说明反应正向进行,故C错误;
D.化学平衡常数K值增大,说明平衡正向进行,故D正确;
故答案为:BD;
点评:本题考查了化学平衡、平衡常数计算影响因素分析判断,难度不大,注意反应特征分析和平衡移动原理的应用,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某学生用托盘天平称量时,误将药品与砝码的位置放颠倒了,待平衡时,称得药品质量的读数为9.5g(1g以下用游码),则药品的实际质量为( )
| A、9g | B、10g |
| C、8.5g | D、8g |
有4种有机物:① ,②
,② ,③
,③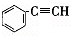 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )
 ,②
,② ,③
,③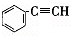 ,④CH3-CH=CH-CN,其中可用于合成
,④CH3-CH=CH-CN,其中可用于合成 结构简式为的高分子材料的正确组合为( )
结构简式为的高分子材料的正确组合为( )| A、①③④ | B、①②③ |
| C、①②④ | D、②③④ |
下列金属之最不正确的是( )
| A、地壳中含量最多的金属元素是铝 |
| B、人体中最多的金属元素是钙 |
| C、熔点最低的金属是汞 |
| D、密度最大的金属元素是金 |
除去NaCl溶液中溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A、NaCl溶液(Na2SO4)加入过量BaCl2溶液后,过滤 |
| B、NaCl溶液(MgCl2)加入适量NaOH溶液后,过滤 |
| C、NaCl溶液(CaCl2)加入适量Na2CO3溶液后,过滤 |
| D、NaCl溶液(碘)加入四氯化碳后,分液 |
下列说法中,不正确的是( )
| A、SiO2和CO2都是酸性氧化物,均可与NaOH溶液反应 |
| B、SiO2不能与任何酸发生反应 |
| C、SiO2和CO2在一定条件下,均可与CaO发生反应 |
| D、SiO2不溶于水,而CO2可与水反应,生成H2CO3 |
含ngHNO3的稀硝酸溶液恰好与mg铁粉完全反应,若HNO3只被还原为NO,则n:m可能是:①5:1②9:2③3:1④2:1⑤4:1( )
| A、②③⑤ | B、①③④ |
| C、②③ | D、①③⑤ |