题目内容
19.碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料.工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺流程如下: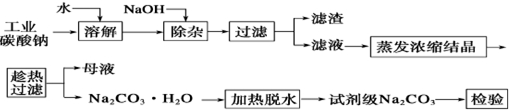
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:
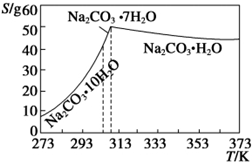
回答下列问题:
(1)滤渣的主要成分为Mg(OH)2、Fe(OH)3.
(2)“趁热过滤”的原因是使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,使后续的加热脱水耗时长.
(3)若在实验室进行“趁热过滤”,可采取的措施是用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤)(写出一种).
(4)已知:Na2CO3•10H2O (s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ•mol-1
Na2CO3•10H2O(s)═Na2CO3•H2O(s)+9H2O(g)△H2=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
分析 工业碳酸钠(钝度约98%)中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3,滤液蒸发浓缩结晶,温度减少至313K时发生突变,溶解度迅速减少,需要趁热过滤析出晶体,加热脱水得到试剂级碳酸钠,
(1)因工业碳酸钠(钝度约98%)中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3沉淀;
(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体;
(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度;
(4)通过观察两个热化学方程式,利用盖斯定律来计算焓变即可.
解答 解:(1)工业碳酸钠(钝度约98%)中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3沉淀,滤渣的主要成分为Mg(OH)2、Fe(OH)3,
故答案为:Mg(OH)2、Fe(OH)3;
(2)根据所给的坐标图可以发现:温度减少至313K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体,所以“趁热过滤”的原因是使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,使后续的加热脱水耗时长,
故答案为:使析出的晶体为Na2CO3•H2O,防止因温度过低而析出Na2CO3•10H20晶体或Na2CO3•7H20晶体,使后续的加热脱水耗时长;
(3)在实验室进行“趁热过滤”时,要注意减少过滤的时间和保持过滤时的温度,可采取的措施是用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤),故答案为:用预热过滤装置(或已预热的布氏漏斗趁热抽滤,或用常压热过滤漏斗进行过滤);
(4)通过观察两个热化学方程式,利用盖斯定律,可将两式相减得到Na2CO3•H2O(S)═Na2CO3(s)+H2O(g),即Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol,
故答案为:Na2CO3•H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
点评 本题是一道综合题,主要考查学生分析和解决问题的能力、实验分离过程的分析应用,综合性强,题目难度大.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 二氧化碳通入苯酚钠溶液能游离出苯酚 | |
| B. | 与FeCl3溶液发生显色反应 | |
| C. | 与NaOH溶液反应 | |
| D. | 常温下苯酚在水中的溶解度不大 |
| A. | CH3COOH | B. |  | C. | 升高温度 | D. | Ba2+ |
| A. | NaOH、KOH、CsOH碱性依次减弱 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Li、Na、K、Rb、Cs的最外层电子数依次减小 | |
| D. | Li、Na、K、Rb、Cs电子层数相同 |
| A. | 熔化状态下不导电的化合物一定是共价化合物 | |
| B. | 只含有共价键的物质一定是共价化合物 | |
| C. | 由两种不同的原子组成的纯净物一定是化合物 | |
| D. | 不含非极性键的晶体一定是共价化合物 |
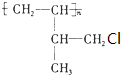
 表示的分子式为C6H14;
表示的分子式为C6H14; 中含有的官能团的名称为羟基、酯基;
中含有的官能团的名称为羟基、酯基;

 .
. .
. 的有机物不能稳定存在)
的有机物不能稳定存在) .
.
 .
.