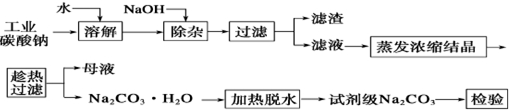
题目内容
14.下列性质的递变规律正确的是( )| A. | NaOH、KOH、CsOH碱性依次减弱 | |
| B. | Li、Na、K、Rb、Cs单质的失电子能力逐渐增强 | |
| C. | Li、Na、K、Rb、Cs的最外层电子数依次减小 | |
| D. | Li、Na、K、Rb、Cs电子层数相同 |
分析 A.金属性越强,最高价氧化物对应水合物的碱性越强,结合同一主族原子序数越大,金属性越强判断;
B.碱金属元素中,原子序数越大,金属性越强,对应单质失电子能力越强;
C.碱金属元素位于ⅠA族,最外层都含有1个电子;
D.随着原子序数的递增,同一主族元素的电子层数逐渐增多.
解答 解:A.同一主族中,原子序数越大,金属性越强,则金属性Na<K<Cs,则最高价氧化物对应水合物的碱性:NaOH<KOH<CsOH,故A错误;
B.Li、Na、K、Rb、Cs位于同一主族,原子序数逐渐增大,则对应单质的失电子能力逐渐增强,故B正确;
C.Li、Na、K、Rb、Cs位于ⅠA族,其最外层电子数都是1,故C错误;
D.Li、Na、K、Rb、Cs的原子序数逐渐增大,电子层数逐渐增多,故D错误;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确同一主族元素性质的相似性和递变性为解答关键,注意掌握原子结构与元素周期律的关系.

练习册系列答案
相关题目
2.某同学写出下列烷烃的名称中,不正确的是( )
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 3-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
2.下列说法中正确的是( )
| A. | 金刚石的能量比石墨高,因此金刚石比石墨更稳定 | |
| B. | 化学反应中的能量变化主要是由化学键变化引起的 | |
| C. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
9.某科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)═2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )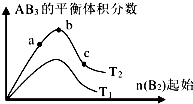

| A. | 反应速率a>b>c | |
| B. | 达到平衡时 A2的转化率大小为:b>a>c | |
| C. | 若T2>T1,则正反应一定是吸热反应 | |
| D. | 达到平衡时,AB3的物质的量大小为:b>c>a |
6.化学与社会发展以及人们生活质量的提高有密切关系.下列的叙述不正确的是( )
| A. | 在1个标准大气压下,水只有在100℃时才能蒸发 | |
| B. | 用13C或14C示踪原子可以进行幽门螺旋杆菌的检测 | |
| C. | 用NaHCO3溶液可以洗去蔬菜、水果等的残留农药 | |
| D. | 使用含钙、镁离子浓度较大的地下水洗衣服,肥皂去污能力会减弱 |
3.下列有关用途的说法中,错误的是( )
| A. | 液态钠可用作核反应堆的传热介质 | |
| B. | 在过渡元素中寻找半导体材料 | |
| C. | 考古时利用l4C测定一些文物的年代 | |
| D. | 235U是一种重要核燃料 |
4.某同学欲配制含有大量下列各离子的溶液,其中能实现的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、HCO32- | D. | Na+、Cu2+、Cl-、SO42- |
 已知1-丙醇和2-丙醇的结构简式如下:
已知1-丙醇和2-丙醇的结构简式如下: .
. ,你判断的依据是因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系.
,你判断的依据是因为其分子有三种不同化学环境的氢原子,所以应该有三个氢原子的吸收峰,并且符合1:1:6的峰面积比关系.