题目内容
1.某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)已知MgCO3与CaCO3性质相似,那么A中MgCO3的分解产物为MgO、CO2.
(2)装置C的作用是除CO2 ,处理尾气的方法为点燃.
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
信息:Fe2+遇K3[Fe(CN)6]溶液产生蓝色沉淀
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②经测定甲组中的黑色粉末有磁性,那么甲组步骤1中反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化成Fe3+,Fe3+遇SCN-显红色;溶液褪色可能的原因为SCN-被Cl2氧化.
④已知装置E是一种防倒吸装置,即防止F中的溶液因压强原因进入D中,导致D的玻璃管破裂,那么从实验安全的角度考虑,图中装置还应在装置B与C之间添加装置E.
分析 碳酸镁受热分解生成氧化镁和二氧化碳,通过锌粉加热反应CO2与Zn作用生成CO气体,装置C中NaOH是用来吸收CO中混有的CO2气体,通过装置C吸收二氧化碳,通过无水氯化钙干燥一氧化碳,通过氧化铁还原得到铁,装置E防止倒吸,最后通过石灰水检验生成的二氧化碳气体;
(1)难溶的碳酸盐受热易分解为氧化物和CO2;
(2)CO2与Zn作用生成CO气体,装置C中NaOH是用来吸收CO中混有的CO2气体;尾气中CO,可利用其可燃性采取点燃法来进行尾气处理;
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
②Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;
③步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红;
④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂.
解答 解:(1)难溶的碳酸盐受热易分解为氧化物和CO2,因此MgCO3受热分解得到产物是MgO与CO2,故答案为:MgO、CO2;
(2)结合实验目的可知在装置B处,CO2与Zn作用生成CO气体,进入后面装置进行实验,故装置C中NaOH是用来吸收CO中混有的CO2气体;CO气体不一定完全反应,因此尾气中会有CO,可利用其可燃性采取点燃法来进行尾气处理,
故答案为:除CO2 ;点燃;
(3)①利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe,故答案为:Fe;
②利用甲组现象可知Fe2O3与CO在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的化学方程式,Fe3O4+8HCl=2FeCl3+FeCl2+4H2O,
故答案为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O;
③因Fe3+遇SCN-显红色,所以步骤4中溶液变红是溶液中Fe2+被Cl2氧化为Fe3+所致、溶液褪色的原因可能是Cl2将SCN-氧化,若该假设成立,则溶液中还存在Fe3+,再继续加入KSCN溶液则溶液变红,
故答案为:Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色;假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立;
④若B处停止加热后,C中液体易倒吸入B中引起玻璃管炸裂,因此可采取的改进措施是在装置BC之间添加装置E防倒吸,故答案为:B;C.
点评 本题考查了铁离子、亚铁离子的检验方法、性质实验方案的设计与评价,题目难度中等,试题综合性较强,注意正确理解、分析题中信息,联系所学的知识进行解答.

| A. |  的命名为:2-甲基-1-丙醇 的命名为:2-甲基-1-丙醇 | |
| B. | 有机物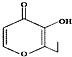 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 (俗称“一滴香”)的一种含苯环的同分异构体能发生银镜反应 | |
| C. | 布洛芬结构如图所示 该物质可发生氧化、还原、加成、消去、取代反应 该物质可发生氧化、还原、加成、消去、取代反应 | |
| D. | 经测定乙二醇和苯组成的混合物中氧的质量分数为8%,则此混合物中碳的质量分数是84% |
| A. | 升高温度,溶液的pH降低 | |
| B. | 加入少量NaOH固体,c(SO32- )与c(Na+)均增大 | |
| C. | c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| D. | c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
①向饱和碳酸钠溶液中通入过量的CO2
②向Fe(OH)3胶体中逐滴滴加入过量H2SO4
③向Ba(NO3)2溶液中通入过量SO2
④向石灰水中通入过量CO2
⑤向硅酸钠溶液中逐滴加入过量的盐酸.
| A. | ①②③ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①③⑤ |
| A. | 品红溶液通入SO2气体后红色消失 | |
| B. | 显红色的酚酞溶液通入SO2后红色消失 | |
| C. | 酸性KMnO4溶液通入SO2后紫色消失 | |
| D. | 溴水通入SO2气体后橙色消失 |
| A. | 在相同的条件下,2 mol氢气与1 mol氧气的总能量小于2 mol水蒸气的总能量 | |
| B. | H2(g)+12O2(g)═H2O(l)△H=-Q1 kJ/mol 则Q1>241.8 | |
| C. | H2(g)+12O2(g)═H2O(l)△H=-Q2 kJ/mol 则Q2<241.8 | |
| D. | 任何条件下,2 L水蒸气分解成2 L氢气与1 L氧气需吸收483.6 kJ热量 |
| A. | H+、NO3-、Na+、SO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、OH- | D. | Na+、Cl-、H+、SO42- |
| A. | 30 g/mol | B. | 60 g/mol | C. | 90g/mol | D. | 120 g/mol |