题目内容
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的( )
| ||
| A、H2C2O4在反应中被氧化 |
| B、KClO3在反应中得到电子 |
| C、CO2是还原产物 |
| D、4 molKClO3参加反应有8 mol电子转移 |
考点:氧化还原反应
专题:
分析:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O(O均为-2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.
| ||
解答:
解:A.H2C2O4为还原剂,在反应中被氧化,故A正确;
B.Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故B正确;
C.CO2是氧化产物,故C错误;
D.4molKClO3参加反应有4mol×(5-4)=4mol,故D错误;
故选AB.
B.Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故B正确;
C.CO2是氧化产物,故C错误;
D.4molKClO3参加反应有4mol×(5-4)=4mol,故D错误;
故选AB.
点评:本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂中元素的变化来解答,难度不大.

练习册系列答案
相关题目
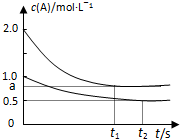 向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲、乙两恒温恒容的密闭容器中,分别充入一定量的A和B,发生反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( ) | 容器 | 甲 | 乙 |
| 容积(L) | 0.5 | 0.5 |
| 反应放热(kJ) | Q1 | Q2 |
| 反应物起始量 | 1 molA 1 molB | 0.5 molA 0.5 molB |
| A、x=1 |
| B、Q1<2Q2 |
| C、根据题中信息无法计算a值 |
| D、保持其他条件不变,起始时向乙容器充入0.2 mol A、0.2 mol B、0.2 mol C,则此时v(正)<v(逆) |
下列工业生产的主要化学反应,不牵涉勒沙特列原理的是( )
| A、合成氨工业 | B、硫酸工业 |
| C、氯碱工业 | D、纯碱工业 |
下列哪一项是通过降低反应所需的能量和增加活化分子的百分数来加快反应速率的( )
| A、增大物质的量浓度 |
| B、增大压强 |
| C、升高温度 |
| D、使用催化剂 |
实验室制Cl2的反应为4HCl(浓)+MnO2═MnCl2+C12↑+2H2O,下列说法错误的是( )
| A、还原剂是HCl,氧化剂是MnO2 |
| B、每生成1 molCl2,转移电子的物质的量为2 mol |
| C、每消耗1 molMnO2,起还原剂作用的HCl消耗4mol |
| D、生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
下列各反应中,氧化反应与还原反应在同种元素中进行的是( )
| A、Cl2+2NaOH=NaCl+NaClO+H2O | ||||
B、2KClO3
| ||||
C、2KMnO4
| ||||
D、2H2O
|
下列叙述正确的是( )
| A、1 mol H2O的质量为18g/mol |
| B、-20℃,18g H2O中含有2mol H和1mol O |
| C、将2mol NaOH 溶于1L水中配成溶液的浓度为2mol?L-1 |
| D、3.01×1023个SO2分子的质量为64g |
在酸性溶液中能大量共存而且为无色透明的溶液是( )
| A、NH4+、Al3+、SO42-、NO3- |
| B、K+、Cu2+、Cl-、CO32- |
| C、K+、MnO4-、NH4+、NO3- |
| D、Na+、K+、HCO3-、NO3- |