题目内容
20.由铜、锌、CuSO4溶液,ZnSO4溶液组成如图所示的原电池,则下列说法正确是( )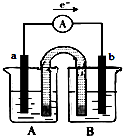
| A. | a极为铜,b极为锌 | |
| B. | A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液 | |
| C. | 当正极质量增加64g时,负极质量减小65g | |
| D. | 盐桥中的阳离子向锌极移动,阴离子向铜极移动 |
分析 由电子转移方向可知a为负极,b为正极,则a为锌,b为铜,A为ZnSO4溶液,B为CuSO4溶液,原电池工作时,金属锌是负极,发生氧化反应,铜是正极,发生还原反应,根据原电池的工作原理来回答.
解答 解:由电子转移方向可知a为负极,b为正极,则a为锌,b为铜,A为ZnSO4溶液,B为CuSO4溶液,
A.由以上分析可知a为锌,b为铜,故A错误;
B.A为ZnSO4溶液,B为CuSO4溶液,故B错误;
C.当正极质量增加64g时,即生成64g铜,转移2mol电子,则负极消耗1mol锌,质量减小65g,故C正确;
D.锌为负极,铜为正极,原电池工作时,阳离子向正极移动,阴离子向负极移动,故D错误.
故选C.
点评 本题考查学生盐桥原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
10.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA | |
| B. | 34gH2O2中含阴离子数为NA | |
| C. | 饱和FeCl3溶液加入沸水中,若有1molFeCl3水解,可生成NA个胶体粒子 | |
| D. | 80mL10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
11.金属钛对人体无毒且有惰性,能与肌肉和骨髓生长在一起,因而有“生物金属”之称.下列有关${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的说法中不正确的是( )
| A. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti属于同种元素 | |
| B. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti的质量数相同 | |
| C. | ${\;}_{22}^{48}$Ti的相对原子质量约为48 | |
| D. | ${\;}_{22}^{48}$Ti和${\;}_{22}^{50}$Ti为不同的核素,互为同位素 |
8.X元素最高价氧化物对应的水化物为HXO3,其气态氢化物为( )
| A. | HX | B. | XH3 | C. | H2X | D. | XH4 |
5.根据如表推断下列说法中不正确的是( )
| 性质 | 金刚石 | 石墨 |
| 外观 | 无色,透明固体 | 灰黑,不透明固体 |
| 沸点 | ? | ? |
| 熔点 | ? | ? |
| 燃烧热/kJ•mol-1 | 395.4 | 393.5 |
| A. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1 | |
| B. | 在相同条件下石墨的熔点应高于金刚石 | |
| C. | 金刚石中碳碳键键能大于石墨中碳碳键键能 | |
| D. | 在相同条件下石墨和金刚石的沸点应相同 |
12.已知反应:A(g)+B(g)═G(g)+D(g)的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为吸热反应 | |
| B. | 反应物的总能量低于生成物的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 若此反应过程中有电子转移,可设计成原电池 |