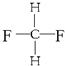
题目内容
10.燃煤和汽车尾气是造成雾霾天气的主要因素.(1)汽车净化的主要原理为:2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g)△H<0
①写出该反应平衡常数的表达式$\frac{C(N{\;}_{2})C{\;}^{2}(CO{\;}_{2})}{C{\;}^{2}(NO)C{\;}^{2}(CO)}$
②若某温度下K=15,某时刻,2L容器中的NO、CO、CO2、N2物质的量均为0.1mol,则此时反应移动方向逆移(填“逆移”、“正移”、“不移”)
(2)煤直接燃烧产生的烟气中含有氮的氧化物,可用甲烷催化还原消除其对大气的污染.
已知:CH2(g)+2NO2(g)?N2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol
H2O(g)=H2O(I)△H=-44.0kJ/mol
①写出常温下甲烷催化还原N2O4(g)生成N2和CO2和液态水的热化学方程式CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol.
②对于甲烷催化还原NO2的反应,以下说法正确的是AC
A.若K(T1)>K(T2),则T1<T2
B.增大压强有利于提高NO2的转化率
C.当有0.4mol碳氢键断裂,同时由0.4mol氢氧键断裂,可知反应达到了平衡状态
D.活化键:E(正)>E(逆)
(3)甲烷燃烧电池可以提升能量利用率,写出当以氢氧化钾为电解质溶液时,该电池的负极反应式是CH4-8e-+10OH-=CO32-+7H2O.
分析 (1)①平衡常数等于生成物浓度的幂之积比上反应浓度幂之积;
②根据该反应的浓度商和化学平衡常数的关系判断平衡移动方向;
(2)①根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
②根据①得出甲烷催化还原NO2的反应为气体体积增大的放热反应,据此分析;
(3)原电池负极发生氧化反应,甲烷在负极通入,氢氧化钾为电解质溶液时,发生氧化反应生成CO32-和H2O.
解答 解:(1)①平衡常数等于生成物浓度的幂之积比上反应浓度幂之积,即:K=$\frac{C(N{\;}_{2})C{\;}^{2}(CO{\;}_{2})}{C{\;}^{2}(NO)C{\;}^{2}(CO)}$,故答案为:K=$\frac{C(N{\;}_{2})C{\;}^{2}(CO{\;}_{2})}{C{\;}^{2}(NO)C{\;}^{2}(CO)}$;
②若某温度下2L容器中的NO、CO、CO2、N2物质的量均为0.1mol,则此时刻体系中NO、CO、CO2、N2的浓度均为0.05 mol•L-1浓度商=$\frac{C(N{\;}_{2})C{\;}^{2}(CO{\;}_{2})}{C{\;}^{2}(NO)C{\;}^{2}(CO)}$=$\frac{0.05×0.05{\;}^{2}}{0.05{\;}^{2}×0.05{\;}^{2}}$=20>15,所以平衡向左移动,故答案为:逆移;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+③×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(g)+CO2(g)△H=-898.1kJ/mol;
②A.因为该反应为放热反应,所以升温平衡向逆反应方向移动,K变小,所以若K(T1)>K(T2),则T1<T2,故正确;
B.因为该反应为气体体积增大的反应,增大压强平衡向逆反应方向移动,降低NO2的转化率,故错误
C.当有0.4mol碳氢键断裂即消耗0.1mol甲烷,同时由0.4mol氢氧键断裂即消耗0.2mol水,正逆反应速率相等,可知反应达到了平衡状态,故正确;
D.因为该反应为放热反应,所以活化键:E(正)<E(逆),故错误;
故选:AC;
(3)原电池负极发生氧化反应,甲烷在负极通入,氢氧化钾为电解质溶液时,发生氧化反应生成CO32-和H2O,负极电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O.
点评 本题考查了盖斯定律求焓变、化学平衡影响因素,化学反应速率,平衡常数概念计算应用,注意平衡的条件分析是解题关键,题目难度中等.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案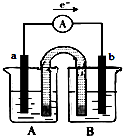
| A. | a极为铜,b极为锌 | |
| B. | A池中盛放的是CuSO4溶液,B池中盛放的是ZnSO4溶液 | |
| C. | 当正极质量增加64g时,负极质量减小65g | |
| D. | 盐桥中的阳离子向锌极移动,阴离子向铜极移动 |
| A. | X、Y、Z的浓度不再变化 | |
| B. | 单位时间生成a mol X,同时生成3a mol Y | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | Z生成的速率与X生成的速率相等 |
| A. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| B. | 用25mL碱式滴定管量取13.50mL Na2CO3溶液 | |
| C. | 用10mL量筒量取5.5mL硫酸溶液 | |
| D. | 用广泛pH试纸不能测得某碱溶液的pH为12.7 |
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
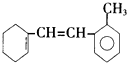
| A. | 分子式为C15H18 | |
| B. | 能使酸性KMnO4溶液褪色,且是氧化反应 | |
| C. | 1mol该物质最多和2molH2加成 | |
| D. | 苯环上的一氯化物有4种 |
| A. | 乙烯、氯乙烯都可通过加聚反应合成塑料 | |
| B. | 油脂、糖和蛋白质都能发生水解反应 | |
| C. | 只用Cu(OH)2:悬浊液就可鉴别乙醇、乙醛和乙酸 | |
| D. | 苯分子中所有的原子都在同一平面上 |
| A. | v(NH3)=0.0020mol/(L•s) | B. | v(O2)=0.0026mol/(L•s) | ||
| C. | v(NO)=0.0020mol/(L•s) | D. | v(H2O)=0.0028mol/(L•s) |
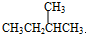 与
与 G.
G. 与
与