题目内容
13.四川含有丰富的矿产资源,钒矿、硫铁矿、铜矿等七种矿产储量位居全国前列.回答下列问题:(1)钒在元素周期表中的位置为第四周期ⅤB族,V3+的价电子排布图为
 .
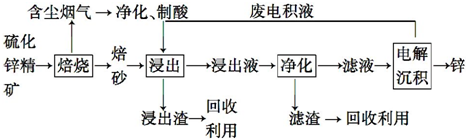
.(2)钒的某种氧化物的晶胞结构如图1所示,其晶体的化学式为VO2
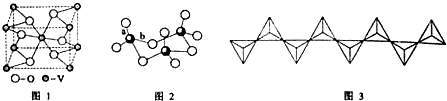
(3)V2O5常用作SO2 转化为SO3的催化剂.SO2 分子中键角<120°(填“>”、“<”或“=”); SO3的三聚体环状结构如图2所示,该结构中S-O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为a(填图2中字母),该分子中含有12个σ键.
(4)V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为正四面体形,例举与VO43-空间构型相同的一种阳离子和一种阴离子NH4+、SO42-(填化学式);也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为NaVO3.
(5)硫能形成很多种含氧酸,如H2SO3、H2SO4.硫的某种含氧酸分子式为H2S2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式
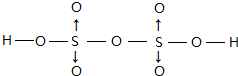 (配位键须注明).
(配位键须注明).(6)利用铜萃取剂M,通过如下反应实现铜离子的富集:

M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取.M水溶性小的主要原因是M能形成分子内氢键,使溶解度减小.
分析 (1)钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第4周期ⅤB族,根据核外电子的轨道能量排布顺序知,1s<2s<2p<3s<3p<4s<3d<4p,因此推断其电子排布式为1s22s22p63s23p63d34s2,注意由于4s轨道能量比3d轨道能量低,因此先排4s轨道,V失去最外层的2个电子后,3d上再失去1个电子得到V3+,因此V3+价电子排布式为3d2,以此书写电子排布图;
(2)由晶胞可知,V位于顶点和体心,O有4个位于面心,2个位于体心,用均摊法计算;
(3)SO2分子中S原子形成2个δ键,孤电子对数为 $\frac{6-2×2}{2}$=1,则SO2分子空间构型为V形,孤对电子的排斥作用力强,键角应小于120°;SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12;
(4)VO43-中,V形成4个δ键,孤电子对数为 $\frac{5+3-4×2}{2}$=0,为正四面体结构,与VO43-空间构型相同的一种阳离子和一种阴离子是NH4+、SO42-,由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,以此判断形成的化合物的化学式;
(5)含氧酸H2S2O7属于二元酸,其结构中所有原子都达到稳定结构,且不存在非极性键,不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键;
(6)分子内氢键的存在,导致水溶性减小,据此解答即可.
解答 解(1)钒的核电荷数为23,则可以推知钒在元素周期表中的位置为第四周期ⅤB族,根据核外电子的轨道能量排布顺序知,1s<2s<2p<3s<3p<4s<3d<4p,因此推断其电子排布式为1s22s22p63s23p63d34s2,注意由于4s轨道能量比3d轨道能量低,因此先排4s轨道,V失去最外层的2个电子后,3d上再失去1个电子得到V3+,因此V3+价电子排布式为3d2,价电子排布图为 ,
,
故答案为:第四周期ⅤB族; ;
;
(2)由晶胞可知,V位于顶点和体心,阳离子个数为1+8×$\frac{1}{8}$=2,O有4个位于面心,2个位于体心,则阴离子个数为4×$\frac{1}{2}$+2=4,则晶体的化学式为:VO2,
故答案为:VO2;
(3)SO2分子中S原子形成2个δ键,孤电子对数为 $\frac{6-2×2}{2}$=1,则SO2分子空间构型为V形,孤对电子的排斥作用力强,键角应小于120°;SO3的三聚体中S原子形成4个δ键,为sp3杂化;SO3的三聚体中每个S形成S=O键和S-O键,S=O键长较短,即a较短,该分子中含有σ键数目为3×4=12,
故答案为:<;a;12;
(4)VO43-中,V形成4个δ键,孤电子对数为 $\frac{5+3-4×2}{2}$=0,为正四面体结构,与VO43-空间构型相同的一种阳离子和一种阴离子是NH4+、SO42-,由链状结构可知每个V与3个O形成阴离子,且V的化合价为+5价,则形成的化合物化学式为NaVO3,
故答案为:正四面体;NH4+、SO42-;NaVO3;
(5)含氧酸H2S2O7属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,不存在氧原子之间、S原子之间形成的共价键,故S原子与氧原子之间形成共价键,O原子与H原子之间形成共价键,且每个S提供孤对电子与2个O原子形成2个配位键,其结构式为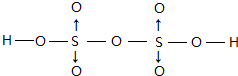 ,
,
故答案为: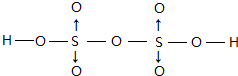 ;
;
(6)由于M能形成分子内氢键,使溶解度减小,
故答案为:M能形成分子内氢键,使溶解度减小.
点评 综合考查物质的结构和性质,涉及价电子排布图、微粒结构、晶胞结构与计算、配合物、空间构型等,侧重于学生的分析能力的考查,难度中等.

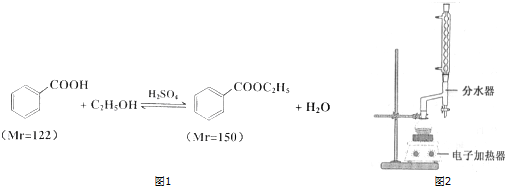
已知:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
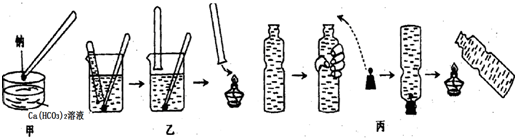
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在65~70℃加热回流2h.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续
加 热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)步骤①中使用分水器不断分离除去水的目的是分离产生的水,使平衡向正反应方向移动,提高转化率.
(2)反应结束的标志是分水器中的水层不再增加时,视为反应的终点.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华.
(5)关于步骤④中的分液操作叙述正确的是AD.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(6)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有蒸馏烧瓶,温度计.
(7)该实验的产率为90%.
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项);酸性条件下高锰酸钾溶液分解的离子方程式4MnO4-+4H+═4MnO2↓+3O2↑+2H2O.
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:2MnO4-+
5C2O42-+16H+═2Mn2++10CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
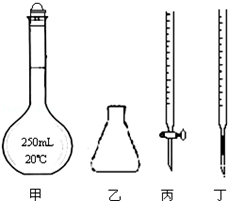
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填如图中的仪器编号).
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加.
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是A.
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.02mol/L.(附原子相对质量K=39 Mn=55 O=16 Na=23 C=12)
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
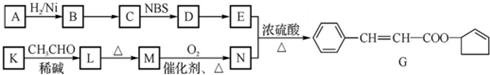
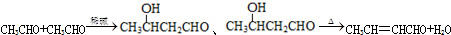
 ,D中官能团的名称为碳碳双键、溴原子.
,D中官能团的名称为碳碳双键、溴原子. .
.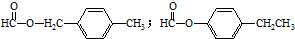 .
.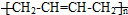 )的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2
)的合成路线:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH=CH2$\stackrel{NBS}{→}$CH3CHBrCH=CH2$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2 .
.

 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
 .
.