题目内容
7.锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: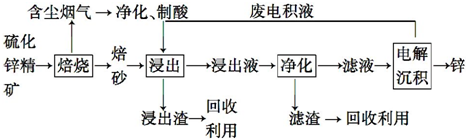
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为ZnO.
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的浸出操作.
(3)浸出液“净化”过程中加入的主要物质为锌粉,其作用是置换出Fe等.
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气是O2.
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生主要反应的离子方程式为2ZnS+4H++O2=2Zn2++2S↓+2H2O.
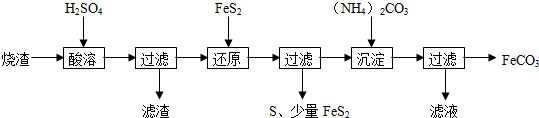
(6)我国古代曾采用“火法”工艺冶炼锌,明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷淀,毁罐取出,…,即倭铅也.”该炼锌工艺过程主要反应的化学方程式为ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
分析 硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)硫化锌精矿主要成分是ZnS,ZnS在氧气燃烧发生氧化还原反应,据此判断锌的存在形式;
(2)ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
(3)锌的活泼性强于铁,能够与二价铁离子反应生成铁;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,据此判断产物;
(5)依据题意“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,可知反应物中含有H+和O2,可以获得非金属单质S,据此写出方程式;
(6)由题意可知:反应物为ZnCO3和C,产物含有Zn,根据反应物和生成物写出化学方程式.
解答 解:硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)ZnS在氧气燃烧发生氧化还原反应,所以产生焙砂的主要成分的化学式为ZnO;
故答案为:ZnO;
(2)ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,离子方程式:Zn+Fe2+=Zn2++Fe;
故答案为:锌粉;置换出Fe等;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,氢氧根离子在阳极上失去电子发生氧化反应生成氧气;
故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O,
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)由题意可知:反应物为ZnCO3和C,产物含有Zn,化学方程式:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,故答案为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
点评 本题以工艺流程题形式考查物质的分离提纯、化学用语书写等,为高频考点和常见题型,侧重于学生的分析能力和实验能力的考查,题目有利于培养学生良好的科学素养,难度中等,清楚工艺流程原理是关键,是对知识迁移的综合运用.

(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
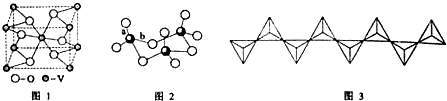
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 2-甲基-3-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2-甲基-4-乙基戊烷 | D. | 1,2-二甲基丁烷 |
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
| C. |  醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类  |
 .
.
 (配位键须注明).
(配位键须注明).