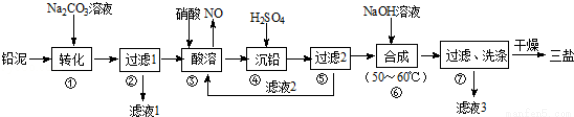
题目内容
17.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 24gMg在22.4LO2中恰好燃烧完全 | |
| B. | 标准状况下,5.6LCO2气体中含有的氧原子数为0.5NA | |
| C. | 在烧杯中1molFe与含2mol氯化氢的浓盐酸恰好反应 | |
| D. | 44.8LNH3所含分子数为2NA |
分析 A、氧气所处的状态不明确;
B、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol氧原子来分析;
C、铁和浓盐酸反应放热,而浓盐酸易挥发;
D、氨气所处的状态不明确.
解答 解:A、氧气所处的状态不明确,故22.4L氧气的物质的量无法计算,则24g镁能否燃烧完全不能确定,故A错误;
B、标况下5.6L二氧化碳的物质的量为0.25mol,而1mol二氧化碳中含2mol氧原子,故0.25mol二氧化碳中含0.5NA个氧原子,故B正确;
C、铁和浓盐酸反应放热,而浓盐酸易挥发,故实际参与反应的盐酸不足2mol,则1mol铁不能反应完全,故C错误;
D、氨气所处的状态不明确,故氨气的物质的量无法计算,则分子个数也无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
8.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的碱性保持不变 | |
| D. | 电池工作时,当有3mol电子通过外电路时,消耗16.8LO2 |
19.下列分离物质的方法不正确的是( )
| A. | 用蒸发结晶的方法分离碳酸钠和水 | |
| B. | 用过滤的方法分离植物油和水 | |
| C. | 用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点118℃) | |
| D. | 用萃取和分液的方法用CCl4从碘水提取碘 |
 ;
; ;
;
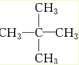
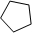
 )的一元取代物;②存在羟甲基( -CH2OH)。写出W所有可能的结构简式:______________________。
)的一元取代物;②存在羟甲基( -CH2OH)。写出W所有可能的结构简式:______________________。 2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志
2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志