题目内容
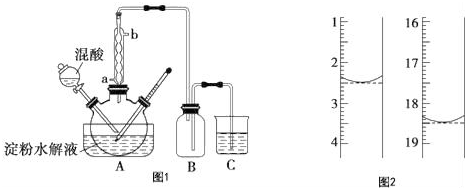
11.将质量为6.3g的Na2SO3暴露在空气中一段时间后溶于水配成100mL溶液.取出50mL,加入过量的稀硫酸溶液得到气体在标准状况下的体积为0.448L;另取该溶液50mL加入足量的氯化钡溶液,求生成的白色沉淀的成分及其质量.分析 亚硫酸钠易被氧化成硫酸钠,取出50mL溶液加入稀硫酸后生成的气体为二氧化硫,根据n=$\frac{V}{{V}_{m}}$计算出二氧化硫的物质的量,从而可知每份溶液中没有被氧化的亚硫酸钠的物质的量及被氧化的物质的量;另一份溶液中加入氯化钡溶液后生成硫酸钡和亚硫酸钡沉淀,根据亚硫酸钠、硫酸钠的物质的量可知硫酸钡、亚硫酸钡的物质的量,再根据m=nM计算出沉淀的质量.
解答 解:6.3g亚硫酸钠的物质的量为:n(Na2SO3)=$\frac{6.3g}{126g/mol}$=0.05 mol,
取出一半与稀硫酸反应,生成二氧化硫的物质的量为:n(SO2)=$\frac{0.448L}{22.4L/mol}$=0.02 mol,根据S原子守恒可知溶液中含有亚硫酸钠的物质的量为:n(Na2SO3)=n(SO2)=0.02 mol,
溶液具有均一性,则另一份加入氯化钡的溶液中含有亚硫酸钠的物质的量也是0.02mol,结合S原子守恒看含有硫酸钠的物质的量为:n(Na2SO4)=0.05mol×$\frac{1}{2}$-0.02mol=0.005 mol,
加入氯化钡溶液后生成的白色沉淀为BaSO4、BaSO3,其中生成亚硫酸钡的物质的量为:n(BaSO3)=0.02 mol,质量为:m(BaSO3)=217g/mol×0.02mol=4.34g,
生成硫酸钡的物质的量为:n (BaSO4)=0.005 mol,质量为:m(BaSO4)=233g/mol×0.005mol=1.165g,
答:生成的白色沉淀为亚硫酸钡和硫酸钡的混合物,含有4.34g亚硫酸钡,含有1.165g硫酸钡.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题侧重考查学生的分析、理解能力及化学计算能力.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案| A. | 质谱仪 | B. | 红外光谱仪 | C. | 元素分析仪 | D. | 核磁共振仪 |
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 11.2g |

| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1 mol该物质与Na反应时,最多消耗Na 4 mol |
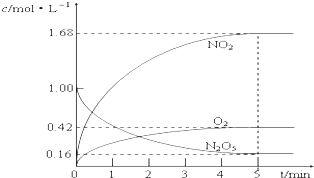 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2
 .
. .
.
 或
或 .
. .
. (写出四者之一即可).
(写出四者之一即可).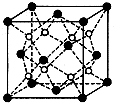 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则: