题目内容
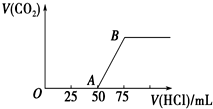 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.(1)写出OA段所发生反应的离子方程式:
(2)NaOH在吸收CO2后,所得溶液的溶质为
(3)产生的CO2体积(标准状况下)为
(4)原NaOH溶液的物质的量浓度为
考点:化学方程式的有关计算
专题:计算题
分析:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗HCl为75mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,
(1)根据发生的反应书写离子方程式;
(2)中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑计算二氧化碳体积;
(4)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算氢氧化钠的浓度.
(1)根据发生的反应书写离子方程式;
(2)中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑计算二氧化碳体积;
(4)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl),进而计算氢氧化钠的浓度.
解答:
解:当生成CO2气体时,发生反应NaHCO3+HCl=NaCl+H2O+CO2↑,由图可知,生成CO2气体至最大,消耗HCl为75mL,若二氧化碳与NaOH反应后溶液中只有Na2CO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将Na2CO3转化为NaHCO3应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应:NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,
(1)由上述分析可知OA段所发生反应的离子方程式:H++OH-═H2O、CO32-+H+═HCO3-,故答案为:H++OH-═H2O、CO32-+H+═HCO3-;
(2)中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,浓度之比是1:1,故答案为:NaOH、Na2CO3;1:1;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L=56mL,故答案为:56mL;
(4)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=
=0.75mol/L,故答案为:0.75mol/L.
(1)由上述分析可知OA段所发生反应的离子方程式:H++OH-═H2O、CO32-+H+═HCO3-,故答案为:H++OH-═H2O、CO32-+H+═HCO3-;
(2)中和NaOH消耗HCl的体积为50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物质的量之比等于两个过程分别消耗盐酸的体积之比,故NaOH、Na2CO3的物质的量之比=25mL:25mL=1:1,浓度之比是1:1,故答案为:NaOH、Na2CO3;1:1;
(3)生成二氧化碳消耗消耗25mL盐酸,根据NaHCO3+HCl=NaCl+H2O+CO2↑,可知CO2体积(标准状况下)为0.025L×0.1mol/L×22.4L/mol=0.056L=56mL,故答案为:56mL;
(4)生成CO2气体最大时,此时溶液中溶质为NaCl,根据钠离子、氯离子守恒可知n(NaOH)=n(NaCl)=n(HCl)=0.075L×0.1mol/L=0.0075mol,故原氢氧化钠溶液的浓度=
| 0.0075mol |
| 0.01L |
点评:本题考查混合物计算,根据消耗盐酸的体积判断图象中各阶段发生的反应是解答的关键,侧重考查学生分析思维能力,难度大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、将试管直立,然后向其中加入块状大理石 |
| B、向盛有某溶液的试管中倾倒稀硫酸检验是否有Ba2+存在 |
| C、实验用完的药品一定要放回原试剂瓶中 |
| D、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
在有机化合物中,一个碳原子与其他原子不能同时形成的化学键是( )
| A、四个共价单键 |
| B、一个双键,一个叁键 |
| C、两个单键,一个双键 |
| D、一个单键,一个叁键 |
将金属钠投入下列物质的溶液中,溶液的质量不会减轻的是( )
| A、氯化氢 | B、硫酸铜 |
| C、氯化镁 | D、碳酸氢钙 |
喷泉是一种自然现象,其产生原因是存在压强差.下列组合不能形成喷泉的是( )
| A、氯气与氢氧化钠溶液 |
| B、氯化氢气体与水 |
| C、氨气与水 |
| D、一氧化氮与水 |
下列叙述正确的是( )
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C、1 L一氧化碳气体一定比1 L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若物质的量相等则体积相等,但质量不相等 |
设NA为阿伏加德岁常数,下列叙述正确的是( )
| A、1L 0.1 mol?L-1碳酸钠溶液中的阴离子总数为0.1NA |
| B、将400 mL 1 mol/L的HNO3溶液与7 g Fe粉充分反应,转移电子数为0.375NA |
| C、标准状况下,14 g氮气中共用电子对的数目为1.5NA |
| D、已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中反应物的转化率为30%,相同条件下,当放出91.8 kJ热量时,生成氨分子的数目为0.6NA |