题目内容
一块由铁、锌两种金属组成的合金12.1g,已知合金中Fe和Zn的物质的量之比为1:1,将该合金与一定体积足量的盐酸反应.
(1)计算反应后生成的氢气在标准状况下的体积.
(2)若反应后溶液体积为500mL,计算该溶液中ZnCl2的物质的量浓度.
(1)计算反应后生成的氢气在标准状况下的体积.
(2)若反应后溶液体积为500mL,计算该溶液中ZnCl2的物质的量浓度.
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)根据m=nM计算金属的物质的量,根据电子注意守恒计算生成氢气的物质的量,再根据V=nVm计算氢气的体积;
(2)由Zn元素守恒可知n(ZnCl2)=n(Zn),根据c=
计算溶液中ZnCl2的物质的量浓度.
(2)由Zn元素守恒可知n(ZnCl2)=n(Zn),根据c=
| n |
| V |
解答:
解:(1)合金中Fe和Zn的物质的量之比为1:1,根据m=nM可知,n(Fe)=n(Zn)=
=0.1mol,根据电子转移守恒可知,生成氢气物质的量为
=0.2mol,故标况下生成氢气的体积为0.2mol×22.4L/mol=4.48L,
答:标况下生成氢气的体积为4.48L;
(2)由Zn元素守恒可知n(ZnCl2)=n(Zn)=0.1mol,溶液中ZnCl2的物质的量浓度为
=0.2mol/L,
答:溶液中ZnCl2的物质的量浓度为0.2mol/L.
| 12.1g |
| 56g/mol+65g/mol |
| 0.1mol×2+0.1mol×2 |
| 2 |
答:标况下生成氢气的体积为4.48L;
(2)由Zn元素守恒可知n(ZnCl2)=n(Zn)=0.1mol,溶液中ZnCl2的物质的量浓度为
| 0.1mol |
| 0.5L |
答:溶液中ZnCl2的物质的量浓度为0.2mol/L.
点评:本题考查化学方程式计算、物质的量有关计算,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
进行化学实验必须注意安全,下列说法正确的是( )
| A、酒精在实验台上燃烧时,用水扑灭火焰 |
| B、给试管中的液体加热时,试管口不能对着别人 |
| C、大量有毒易燃气体在室内扩散,应立即打开排气扇开关 |
| D、不慎将浓硫酸沾到皮肤上,应用较多的水冲洗,然后涂上硼酸溶液 |
已知Xn-、Yn+、Z三种微粒具有相同的核外电子层结构,下列分析中正确的是( )
| A、离子半径大小关系是Xn-<Yn+ |
| B、Z一定是稀有气体元素的原子 |
| C、原子序数关系是Z>Y>X |
| D、原子半径关系是Y<X |
短周期元素X、Y、Z、R、W五种元素原子序数依次增大,其中X与Z、Y与W分别为同族元素.原子半径X<Y<W<R<Z,W原子的最外层电子数比内层电子总数少4,Z、R的核外电子数之和与Y、W核外电子数之种相等.下列说法不正确的是( )
| A、Y、Z、R的简单离子具有相同的电子层结构 |
| B、X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| C、X2Y分子同存在氢键,故X2Y比X2W稳定 |
| D、由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
把20g氢氧化钠溶于水,配成500mL溶液,此溶液的物质的量浓度为( )
| A、2 mol?L-1 |
| B、1 mol?L-1 |
| C、0.5 mol?L-1 |
| D、1.5mol?L-1 |
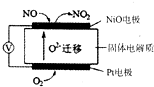 NO2是汽车尾气中的主要污染物之一.
NO2是汽车尾气中的主要污染物之一.
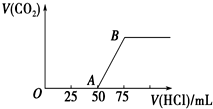 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.