题目内容
将金属钠投入下列物质的溶液中,溶液的质量不会减轻的是( )
| A、氯化氢 | B、硫酸铜 |
| C、氯化镁 | D、碳酸氢钙 |
考点:钠的化学性质
专题:几种重要的金属及其化合物
分析:钠和水反应生成氢氧化钠和氢气,会出现气体,如果溶液质量减轻,则说明从溶液中放出气体的质量大于溶液增加的质量,根据金属钠和下列物质间的反应情况来回答;
解答:
解:A、钠和盐酸的反应方程式为:2Na+2HCl═2NaCl+H2↑,根据方程式知,溶液增加的质量=m(Na)-m(H2),故A正确;
B、钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应,方程式为:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓,将两个方程式相加:2Na+2H2O+CuSO4═H2↑+Na2SO4+Cu(OH)2↓,由方程式知,溶液的质量减轻,故B错误;
C、钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和氯化镁反应,方程式为:2NaOH+MgCl2═2NaCl+Mg(OH)2↓,将两个方程式相加:2Na+2H2O+MgCl2═H2↑+2NaCl+Mg(OH)2↓,由方程式知,溶液的质量减轻,故C错误;
D、钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和和碳酸氢钙反应生成碳酸钙沉淀,方程式为:2NaOH+Ca(HCO3)2═Na2CO3+CaCO3↓+2H2O,由方程式知,溶液的质量减轻,故D错误;
故选:A.
B、钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应,方程式为:2NaOH+CuSO4═Na2SO4+Cu(OH)2↓,将两个方程式相加:2Na+2H2O+CuSO4═H2↑+Na2SO4+Cu(OH)2↓,由方程式知,溶液的质量减轻,故B错误;
C、钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和氯化镁反应,方程式为:2NaOH+MgCl2═2NaCl+Mg(OH)2↓,将两个方程式相加:2Na+2H2O+MgCl2═H2↑+2NaCl+Mg(OH)2↓,由方程式知,溶液的质量减轻,故C错误;
D、钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,生成的氢氧化钠和和碳酸氢钙反应生成碳酸钙沉淀,方程式为:2NaOH+Ca(HCO3)2═Na2CO3+CaCO3↓+2H2O,由方程式知,溶液的质量减轻,故D错误;
故选:A.
点评:本题考查了钠及氢氧化钠的性质,难度不大,注意根据方程式运用差量法分析反应后溶液质量的变化即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100mL的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后两极收集到的气体在相同条件下体积相同.则下列描述正确的是( )
| A、电路中共转移0.9mol电子 |
| B、阳极得到的气体中有O2且其物质的量为0.35mol |
| C、阴极质量增加3.2g |
| D、若改用铜棒做电极电解该溶液,电极反应不变 |
下列说法正确的是( )
①铁元素位于元素周期表中第四周期第ⅧB族
②保存FeSO4溶液,为防止其变质,需向溶液中加入铁粉和稀硫酸
③工业上通过电解氯化镁溶液制取单质镁
④将SiO2和水加热可制得H2SiO3
⑤氯水久置之后,最终会变成稀盐酸
⑥向偏铝酸钠溶液中通入二氧化碳,产生白色沉淀,继续通入二氧化碳,沉淀不溶解.
①铁元素位于元素周期表中第四周期第ⅧB族
②保存FeSO4溶液,为防止其变质,需向溶液中加入铁粉和稀硫酸
③工业上通过电解氯化镁溶液制取单质镁
④将SiO2和水加热可制得H2SiO3
⑤氯水久置之后,最终会变成稀盐酸
⑥向偏铝酸钠溶液中通入二氧化碳,产生白色沉淀,继续通入二氧化碳,沉淀不溶解.
| A、①②⑥ | B、②③⑥ |
| C、②⑤⑥ | D、②④⑤ |
已知Xn-、Yn+、Z三种微粒具有相同的核外电子层结构,下列分析中正确的是( )
| A、离子半径大小关系是Xn-<Yn+ |
| B、Z一定是稀有气体元素的原子 |
| C、原子序数关系是Z>Y>X |
| D、原子半径关系是Y<X |
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶质的质量分数为ω,物质的量浓度为c mol?L-1.则下列选项不正确的是( )
A、溶质的质量分数为ω=
| ||
| B、用水稀释该溶液,OH- 的物质的量增加 | ||
| C、该溶液中共有6种微粒 | ||
| D、上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5ω |
下列变化过程一定释放出能量的是( )
| A、分子拆成原子 |
| B、物质从液态变到气态 |
| C、物质溶解在水中 |
| D、酸碱中和反应 |
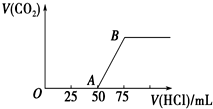 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图所示.