题目内容
14.有关常温下浓度均为0.1mol•L-1的NH3•H2O和NaOH溶液,下列说法正确的是( )| A. | 两种溶液的pH相同 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | 分别与等物质的量浓度、等体积的盐酸混合后,所得溶液都显中性 | |
| D. | 等体积的两溶液与硫酸完全反应,消耗硫酸的量相同 |
分析 A.氨水为弱碱,在溶液中只能部分电离,则氨水的pH较小;
B.氨水为弱碱,电离方程式用可逆号;
C.氨水与盐酸反应生成强酸弱碱盐氯化铵,溶液呈酸性;
D.两溶液都是一元碱,等体积、等浓度的二者与硫酸完全反应,消耗硫酸溶的量相同.
解答 解:A.NH3•H2O为弱电解质,则浓度相同时氨水的pH小于NaOH溶液,故A错误;
B.NH3•H2O为弱电解质,存在电离平衡,正确的电离方程式:NH3•H2O?NH4++OH-,故B错误;
C.分别与等物质的量浓度、等体积的盐酸混合后,氢氧化钠所得混合液呈中性,而一水合氨为弱碱,反应后生成氯化铵,溶液呈酸性,故C错误;
D.等体积、等浓度的NH3•H2O和NaOH溶液与硫酸完全反应,二者都是一元碱,则反应消耗硫酸的量相同,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡、酸碱混合的定性判断,题目难度不大,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.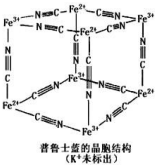 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |
5.下列物质互为同分异构体的是( )
| A. | 氧气和臭氧 | B. | 正丁烷和异丁烷 | C. | H2O和D2O | D. | 612C和614C |
2.下列有机物的命名正确的是( )
| A. |  | B. | (CH3)2CHCH3 甲基丙烷 | ||
| C. |  | D. |  |
9.常温下能与水反应的非金属单质是( )
| A. | Na | B. | C | C. | Cl2 | D. | NH3 |
19.下列说法正确的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了加成反应 | |
| B. | 苯可以使溴水褪色,发生了取代反应 | |
| C. | 乙醛在一定条件下与氢气反应生成乙醇,发生了氧化反应 | |
| D. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 |
6.有关下列说法不正确的是( )
| A. | 二氯丙烷(C3H6Cl2)的同分异构体共有3种 | |
| B. | 蛋白质溶液具有丁达尔效应,说明该蛋白质分子直径约1nm~100nm | |
| C. | 光导纤维被广泛应用,制造它的主要原料是二氧化硅 | |
| D. | 福尔马林溶液可以使蛋白质变性,所以农业上可以用福尔马林溶液浸制生物标本 |
3.化工厂经常用浓氨水检验输送氯气的管道是否漏气,其反应为3Cl2+8NH3=N2+6NH4Cl,当有3mol NH4Cl产生时,被氧化的氨气是( )
| A. | 4mol | B. | 1mol | C. | 8mol | D. | 2mol |
16.下列叙述正确的是( )
| A. | 标准状况下,22.4LSO3中含有氧原子的数目为3NA | |
| B. | 18gH218O 中含有的电子数为10NA | |
| C. | 常温下,4g甲烷中含有C-H键的数目为NA | |
| D. | 24g镁原子最外层电子数为NA |