题目内容
6.有关下列说法不正确的是( )| A. | 二氯丙烷(C3H6Cl2)的同分异构体共有3种 | |
| B. | 蛋白质溶液具有丁达尔效应,说明该蛋白质分子直径约1nm~100nm | |
| C. | 光导纤维被广泛应用,制造它的主要原料是二氧化硅 | |
| D. | 福尔马林溶液可以使蛋白质变性,所以农业上可以用福尔马林溶液浸制生物标本 |
分析 A.二氯代产物可以取代同一碳原子上的2个H原子,可以取代不同碳原子上的H原子;
B.胶体具有丁达尔效应;
C.二氧化硅为光导纤维的主要原料;
D.福尔马林可用于杀菌消毒,防止标本变质.
解答 解:A.丙烷二氯代产物取代同一碳原子上的2个H原子,有2种:CHCl2CH2CH3,CH3CCl2CH3,取代不同碳原子上的H原子,有2种:CH2ClCHClCH3,CH2ClCH2CH2Cl,共有4种,故A错误;
B.丁达尔效应为胶体的特征性质,蛋白质溶液具有丁达尔效应,说明直径约1nm~100nm,故B正确;
C.二氧化硅具有良好的遮光性和全反射性,为光导纤维的主要原料,故C正确;
D.福尔马林可使蛋白质变性,可用于杀菌消毒,防止标本变质,故D正确.
故选A.
点评 本题考查元素化合物知识,为高考常见题型,侧重于学生的分析能力的考查,题目涉及二氧化硅、蛋白质、甲醛的性质,把握常见物质的性质、分类为解答的关键,题目难度不大.

练习册系列答案
相关题目
16.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图:
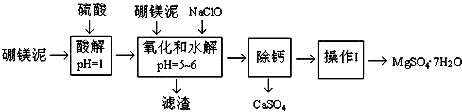
根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施升温、把硼镁泥粉碎、搅拌等.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是Mn2++ClO-+H2O═MnO2↓+2H++Cl-.在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
A.KSCN B.淀粉-KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤蒸发浓缩(结晶)、趁热过滤.
(6)现有l.60t硼镁泥,生产MgSO4•7H2O,若生产过程的产率为50%,则能生产出MgSO4•7H2O产品1.97t (计算结果保留三位有效数字).

根据题意回答下列问题:
(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施升温、把硼镁泥粉碎、搅拌等.
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是Mn2++ClO-+H2O═MnO2↓+2H++Cl-.在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+.
A.KSCN B.淀粉-KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如表:
| 温度/℃ | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)现有l.60t硼镁泥,生产MgSO4•7H2O,若生产过程的产率为50%,则能生产出MgSO4•7H2O产品1.97t (计算结果保留三位有效数字).
17.下列属于高分子化合物且在自然界中原来并不存在的是( )
| A. | 淀粉 | B. | 蛋白质 | C. | 纤维素 | D. | 聚乙烯 |
14.有关常温下浓度均为0.1mol•L-1的NH3•H2O和NaOH溶液,下列说法正确的是( )
| A. | 两种溶液的pH相同 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | 分别与等物质的量浓度、等体积的盐酸混合后,所得溶液都显中性 | |
| D. | 等体积的两溶液与硫酸完全反应,消耗硫酸的量相同 |
1.下列实验操作或方法正确的是( )
| A. | 配制银氨溶液时,将硝酸银溶液慢慢滴加到稀氨水中,产生沉淀后继续滴加到沉淀刚好溶解为止 | |
| B. | 鉴别苯和乙酸乙酯:分别加入NaOH溶液加热振荡,观察油层是否消失或变薄 | |
| C. | 配制一定物质的量浓度的溶液时,仰视定容会导致浓度偏高 | |
| D. | 向淀粉溶液中加入稀硫酸,加热,再加入新制银氨溶液,未出现银镜,说明淀粉尚未水解 |
11.环保、安全的铝-空气电池的工作原理如图所示,下列有关叙述错误的是( )
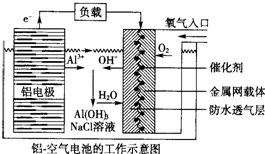

| A. | NaCl的作用是增强溶液的导电性 | |
| B. | 正极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 电池工作过程中,电解质溶液的pH不断增大 | |
| D. | 用该电池作电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g |
8.下列溶液中,溶质的物质的量浓度为0.1mol/L的是( )
| A. | 1L溶液中含有4g NaOH | B. | 1L水中溶解4gNaOH | ||
| C. | 0.5L溶液中含有0.2mol H2SO4 | D. | 9.8g H2SO4溶于1L水配成溶液 |
 (足量)
(足量) +4H2$\stackrel{催化剂}{→}$
+4H2$\stackrel{催化剂}{→}$ .
.