题目内容
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,第一电离能从大到小的顺序是 (填元素符号);
(2)E的离子结构示意图为 ,A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出其电离方程式 ;
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的结构式 ;
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.写出Y与盐酸反应生成两种新物质的化学方程式为 .
(1)B、C、D、E四种元素的原子,第一电离能从大到小的顺序是
(2)E的离子结构示意图为
(3)A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的结构式
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.写出Y与盐酸反应生成两种新物质的化学方程式为
考点:原子结构与元素周期律的关系
专题:
分析:短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,则A处于第一周期,B、C处于第二周期,A原子的最外层电子数等于其电子层数,则A为氢元素;C原子的价电子构型为nsnnpn+1,s能级只能容纳2个电子,即n=2,C原子的价电子构型为2s22p3,故C为氮元素;C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,则B原子最外层电子数为5-1=4,则B为碳元素;D原子的2p能级上有两个未成对电子,原子序数大于氮元素,则D原子的价电子构型为2s22p4,故D为氧元素;D和E可以形成原子个数比为1:1和1:2的两种离子化合物,则E为Na元素,据此解答.
解答:
解:短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,则A处于第一周期,B、C处于第二周期,A原子的最外层电子数等于其电子层数,则A为氢元素;C原子的价电子构型为nsnnpn+1,s能级只能容纳2个电子,即n=2,C原子的价电子构型为2s22p3,故C为氮元素;C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,则B原子最外层电子数为5-1=4,则B为碳元素;D原子的2p能级上有两个未成对电子,原子序数大于氮元素,则D原子的价电子构型为2s22p4,故D为氧元素;D和E可以形成原子个数比为1:1和1:2的两种离子化合物,则E为Na元素,
(1)同周期自左而右第一电离能呈增大趋势,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能从大到小的顺序是N>O>C>Na,故答案为:N>O>C>Na;
(2)E的离子为Na+,离子结构示意图为 ;H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,电离方程式为:H2O2?H++HO2-,故答案为:
;H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,电离方程式为:H2O2?H++HO2-,故答案为: ;H2O2?H++HO2-;
;H2O2?H++HO2-;
(3)H、C、O三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物,应为HCHO.其电子式为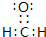 ,结构式为
,结构式为 ,故答案为:
,故答案为: ;
;
(4)N和Na形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质,分解为Na与氮气,令组成为NaxNy,则23x+14y=65,则x=1,y=3,故则Y为NaN3,与盐酸反应的化学方程式为:NaN3+HCl=NaCl+HN3 ↑,
故答案为:NaN3+HCl=NaCl+HN3 ↑.
(1)同周期自左而右第一电离能呈增大趋势,氮元素原子2p能级容纳3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能从大到小的顺序是N>O>C>Na,故答案为:N>O>C>Na;
(2)E的离子为Na+,离子结构示意图为
 ;H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,电离方程式为:H2O2?H++HO2-,故答案为:
;H、O可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,该化合物为H2O2,电离方程式为:H2O2?H++HO2-,故答案为: ;H2O2?H++HO2-;
;H2O2?H++HO2-;(3)H、C、O三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物,应为HCHO.其电子式为
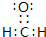 ,结构式为
,结构式为 ,故答案为:
,故答案为: ;
;(4)N和Na形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质,分解为Na与氮气,令组成为NaxNy,则23x+14y=65,则x=1,y=3,故则Y为NaN3,与盐酸反应的化学方程式为:NaN3+HCl=NaCl+HN3 ↑,
故答案为:NaN3+HCl=NaCl+HN3 ↑.
点评:本题考查结构性质位置关系,侧重对常用化学用语的考查,推断元素是解题根据,难度中等,(4)为易错点,要求学生关注身边的化学.

练习册系列答案
相关题目
T℃时,CaCO3和CaF2的Ksp分别为1.0×10-10和4.0×10-12.下列说法正确的是( )
| A、T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B、T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C、T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
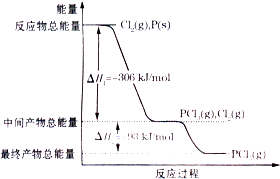 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )| A、P(s)和Cl2(g)一步直接生成1 mol PCl5(g) 的△H小于△H1+△H2 |
| B、PCl5(g)?PCl3(g)+Cl2(g)加入催化剂,达平衡时PCl5的分解率减小 |
| C、生成PCl3(g)的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H=-306 KJ/mol |
| D、工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,降温后,再和Cl2反应生成PCl5,这样有助于提高产率 |
盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是( )
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、NaHCO3溶液中:[H]++[H2CO3]=[OH-] |
| C、10 mL 0.10 mol?L-1 CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:[Na+]>[CH3COO-]>[OH-]>[H+] |
| D、中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
下列食物中属于碱性食物的是( )
| A、桔子 | B、鸡肉 | C、蛋黄 | D、鱼肉 |