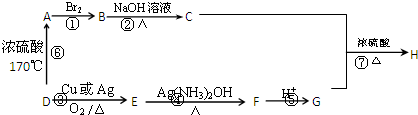
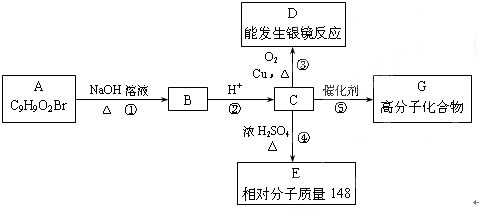
题目内容
电石中的碳化钙和水能完全反应,利用反应产生的气体排水,测量出水的体积,可计算出标准状况下乙炔的体积,从而测定电石中碳化钙的含量:
(1)碳化钙与水反应的化学方程式为:
(2)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器从左到右连接的顺序(填各仪器的序号)是 6接3接 接 接 接 .
(3)仪器4的作用是 ;实验中,我们常用饱和食盐水代替水,其目的是 .
(4)若电石中含有硫化钙等杂质,则实验中产生的气体会存在难闻的气味,这时测定结果将会 (填“偏大”、“偏小”或“不受影响”),我们可以用 (填试剂)加以除去.
(5)2000年,有三位科学家由于研究开发导电塑料上有卓越的成就,而获得诺贝尔化学奖.“聚乙炔”就是一种导电塑料,试写出由乙炔在一定条件下聚合生成聚乙炔的化学方程式 .
(1)碳化钙与水反应的化学方程式为:
(2)若用下列仪器和导管组装实验装置:
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 导管及仪器 |  |  |  |  |  | 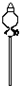 |
| 每个橡皮塞上都打了两个孔 | ||||||
(3)仪器4的作用是
(4)若电石中含有硫化钙等杂质,则实验中产生的气体会存在难闻的气味,这时测定结果将会
(5)2000年,有三位科学家由于研究开发导电塑料上有卓越的成就,而获得诺贝尔化学奖.“聚乙炔”就是一种导电塑料,试写出由乙炔在一定条件下聚合生成聚乙炔的化学方程式
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)碳化钙与水反应生成乙炔和氢氧化钙;
(2)制备气体时并测量气体实验步骤应按照检验气密性→装药品→发生反应→量取体积的步骤操作;
(3)制备气体并测量气体体积时注意排水瓶(即4)中的两个导管应短进长出,利用排出液体体积到量筒中测定气体体积,饱和食盐水代替水减少反应速率生成平稳的乙炔气流;
(4)生成的气体中含有硫化氢气体,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应.
(5)乙炔在一定条件下聚合生成聚乙炔.
(2)制备气体时并测量气体实验步骤应按照检验气密性→装药品→发生反应→量取体积的步骤操作;
(3)制备气体并测量气体体积时注意排水瓶(即4)中的两个导管应短进长出,利用排出液体体积到量筒中测定气体体积,饱和食盐水代替水减少反应速率生成平稳的乙炔气流;
(4)生成的气体中含有硫化氢气体,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应.
(5)乙炔在一定条件下聚合生成聚乙炔.
解答:
解:(1)碳化钙与水反应生成乙炔和氢氧化钙,反应的离子方程式为:CaC2+2H2O→C2H2↑+Ca(OH)2,故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)应按照发生装置(3和6)、排水装置(5)和接受装置(4)连接,连接时要考虑排水瓶(即5)中的两个导管应短进长出,本实验仪器的连接顺序为:6、3、1、5、2、4,
故答案为:1;5;2;4;
(3)制备气体并测量气体体积时注意排水瓶(即5)中的两个导管应短进长出,仪器4的作用是利用排出液体体积到量筒中测定气体体积,从而知道所产生的乙炔的体积,饱和食盐水代替水减少反应速率生成平稳的乙炔气流;
故答案为:测量水的体积,从而知道所产生的乙炔的体积;减慢反应速率,产生平稳的气流;
(4)若电石中含有硫化钙等杂质,则实验中产生的气体会存在难闻的气味,生成的气体中含有硫化氢气体,这时测定结果将会偏大,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应,可以用硫酸铜溶液或氢氧化钠溶液除去;
故答案为:偏大;硫酸铜溶液或氢氧化钠溶液;
(5)由乙炔在一定条件下聚合生成聚乙炔的化学方程式为:n CH≡CH
 ,故答案为:n CH≡CH
,故答案为:n CH≡CH
 .
.
(2)应按照发生装置(3和6)、排水装置(5)和接受装置(4)连接,连接时要考虑排水瓶(即5)中的两个导管应短进长出,本实验仪器的连接顺序为:6、3、1、5、2、4,
故答案为:1;5;2;4;
(3)制备气体并测量气体体积时注意排水瓶(即5)中的两个导管应短进长出,仪器4的作用是利用排出液体体积到量筒中测定气体体积,从而知道所产生的乙炔的体积,饱和食盐水代替水减少反应速率生成平稳的乙炔气流;
故答案为:测量水的体积,从而知道所产生的乙炔的体积;减慢反应速率,产生平稳的气流;
(4)若电石中含有硫化钙等杂质,则实验中产生的气体会存在难闻的气味,生成的气体中含有硫化氢气体,这时测定结果将会偏大,硫化氢能与硫酸铜溶液或氢氧化钠溶液反应,可以用硫酸铜溶液或氢氧化钠溶液除去;
故答案为:偏大;硫酸铜溶液或氢氧化钠溶液;
(5)由乙炔在一定条件下聚合生成聚乙炔的化学方程式为:n CH≡CH
| 一定条件 |
 ,故答案为:n CH≡CH
,故答案为:n CH≡CH | 一定条件 |
 .
.
点评:本题考查乙炔的制备和测量问题,本题难度不大,注意气体制备方法,特别是实验仪器的连接顺序一定要掌握好.

练习册系列答案
相关题目
小华家中有如下生活用品:碘酒、食盐、食醋、84消毒液(内含NaClO),小华利用上述用品不能完成的任务是( )
| A、检验买来的奶粉中是否加有淀粉 |
| B、检验自来水中是否含有Cl- |
| C、除去保温瓶中的水垢 |
| D、洗去白色衣服上的番茄汁 |
三甲基一氯硅[(CH3)3SiCl]是一种生产有机硅化合物的原料,遇明火或氧化剂会引起爆炸,在空气中燃烧生成一氧化碳、二氧化碳、二氧化硅和氯化氢,另外与水接触可产生盐酸.下列说法错误的是( )
| A、保存三甲基一氯硅时应密封防水 |
| B、扑灭三甲基一氯硅引发的着火,应使用二氧化碳、干粉灭火剂,并用弱碱性水处理 |
| C、三甲基一氯硅水溶液pH小于7 |
| D、三甲基一氯硅由碳、氢、硅、氯四个原子构成 |
有机物的种类繁多,但其命名是有规则的.下列有机物的命名正确的是( )
| A、3,3-二甲基-4-乙基戊烷 |
| B、(CH3)2CHCH=CH2 3-甲基丁烯 |
C、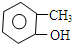 邻甲基苯酚 邻甲基苯酚 |
| D、CH2Cl-CH2Cl 二氯乙烷 |
我国选择( )作铁强化食物的载体.
| A、食盐 | B、酱油 | C、醋 | D、味精 |
以惰性电极电解500mL0.4mol/L的CuCl2溶液.若阳极上所产生气体的物质的量为0.25mol,则阴极上析出Cu的质量为( )
| A、16g | B、32g |
| C、19.2g | D、12.8g |